-
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
A. X单质不易与水反应 B. XO2可被碳或氢还原为X
C. XCl4的沸点比SiCl4的高 D. XH4的稳定性比SiH4的高
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 在标准状况下,11.2LCC14分子中含碳原子数目为0.5NA
B. 常温常压下,28g由N2和CO组成的混合气体含有的原子数目为NA
C. 1.8g 含H2O 和H218O 的混合物中含中子数目为0.9NA
D. 常温常压下,92gNO2和N2O4的混合气体含有的原子数为6NA
难度: 中等查看答案及解析
-
已知A、B是周期表中同主族相邻的两元素,A、B所在周期分别有a、b种元素。若A 的原子序数为x,则B的原子序数可能为
①x+a ②x-a ③x+b ④x-b
A. ①③ B. ①④ C. ②③ D. ①②③④
难度: 中等查看答案及解析
-
下列说法正确的是
①离子化合物中一定含离子键,也可能含共价键
②共价化合物中可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤构成单质分子的粒子不一定存在共价键
⑥不同元素组成的多原子分子里的化学键一定是极性键
⑦有化学键断裂的变化属于化学变化
A. ①③⑤ B. ②④⑥ C. ①③④ D. ③⑤⑦
难度: 简单查看答案及解析
-
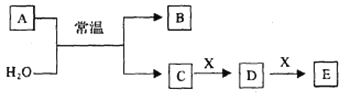
X、Y、Z三种短周期元素,原子半径的大小关系为:r(y)>r(x)>r(z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是
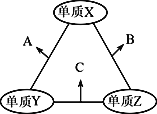
A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸点高于C的沸点
D. A和C不可能发生氧化还原反应
难度: 中等查看答案及解析
-
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是
A. 原子半径A>B>D>C B. 原子序数a>b>c>d
C. 离子半径D>C>B>A D. 金属性B>A,非金属性D>C
难度: 中等查看答案及解析
-
X、Y、Z为原子序数依次增大的短周期主族元素,三种元素属于不同周期。下列转化关系中,A、B、C是X、Y、Z对应的三种气态单质,其余均为常见化合物。下列分析正确的是( )
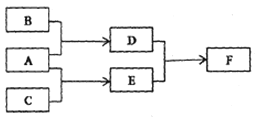
A. 离子半径; Y>Z B. Z的含氧酸均为强酸
C. 与Y同周期氢化物中D最稳定 D. F 含离子键和共价键
难度: 中等查看答案及解析
-
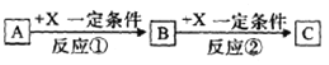
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W 最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系,(图中“--”相连的两种物质能发生反应)。下列判断一定正确的是
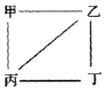
A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 4种原子中,Y原子半径最大 D. W的最高化合价为+7
难度: 困难查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与氢原子构成HmX分子,在agHmX中所含质子的物质的量是( )
A.
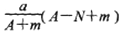 mol B.
mol B. mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
元素周期表中卤族元素(F→I) 的单质和化合物的性质,从上到下呈现一定的递变性。下列叙述中正确的是( )
①氢卤酸(HX) 的酸性依次减弱 ②单质的颜色加深 ③气态氢化物的佛点依次增高
④单质的沸点升高 ⑤阴离子的还原性增强
A. ①②④ B. ②③④⑤ C. ②④⑤ D. ①③⑤
难度: 简单查看答案及解析
-
16O、17O、18O是氧元素的三种核素,H、D、T是氢元素的三种核素,NA表示阿伏伽德罗常数的值,下列说法正确的是
A. 16O、17O、18O互为同素异形体
B. H218O 与T216O的相对分子质量相同
C. 氢的同位素与氧的同位素相结合为水,可得16种水分子
D. 相同质量的16O2与18O2所含中子数之比为9:10
难度: 简单查看答案及解析
-
根据中学化学教材所附元素周期表判断,下列叙述中正确的是
A. L电子层电子数为奇数的所有元素都是非金属
B. 同一主族的两种元素的原子序数之差可能是16、26、36、46
C. 只有第IIA族元素的原子最外层有2个电子
D. 由左至右第8、9、10 三列元素中没有非金属元素
难度: 中等查看答案及解析
-
有A、B、C、D、E五种金属元素.在相同条件下,B元素的最高价氧化物对应水化物的碱性比A的弱;A、B单质均可以从C盐溶液中置换出C;D单质可以与冷水剧烈反应并放出氢气;A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气.则五种金属元素的金属性由强到弱的顺序为( )
A. D>B>A>C>E B. D>A>B>C>E
C. A>B>C>E>D D. D>E>B>A>C
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是
元素代号
A
B
D
E
G
H
I
J
化合价
-1
-2
+4、-4
+7、-1
+5、-3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0. 143
0.160
0.186
A. A的单质能将E单质从HE的溶液中置换出来
B. A、H、J的离子半径由大到小顺序是A>J>H
C. G 元素的单质不存在同素异形体
D. H 的最高价氧化物能溶于氨水
难度: 中等查看答案及解析
-
X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17。下列说法正确的是:
A. 四种元素的原子半径由小到大的顺序为:r(X)<r(Y)<r(Z)<r(W)
B. H2Z的沸点比H2W低
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D. X、Y、Z既能形成离子化合物,又能形成共价化合物
难度: 中等查看答案及解析
-
短周期元素 T、Q、R、W 在元素周期表中的位置如图所示,其中 T 所处的周期序数与主族 族序数相等.它们的最高价氧化物水化物依次为甲、乙、丙、丁.下列叙述不正确的是( )
A. 甲、乙、丙、丁受热均易分解
B. 常温下丁的浓溶液可用 T 单质所制的容器来盛装
C. 丁的浓溶液与 Q 的单质加热发生反应,可生成体积比为 1:2 的两种气体
D. R 的氧化物在空气中与其它物质作用可形成光化学烟雾
难度: 中等查看答案及解析