-
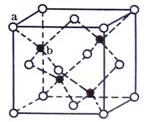
2015年8月12日,天津滨海新区某公司仓库发生爆炸,事发仓库里存放了大量的硝酸铵( NH4NO3)、氰化钠(NaCN)、电石(CaC2)和金属钠等危险化学品。下列有关叙述不正确的是
A.金属钠属于危化品中的易燃固体,其着火时不能用水灭火
B.氰化钠( NaCN)是一种剧毒危险品,其水溶液呈碱性
C.实验室里可将少量的钠保存于煤油中
D.NH4N03、NaCN、CaC2中均含有离子键和非极性共价键
难度: 中等查看答案及解析
-
中国女药学家屠呦呦因研制新型抗疟药青蒿素和双氢青蒿素成果而获得2015年诺贝尔生理学或医学奖。青蒿素和双氢青蒿素结构如下图所示:

下列关于青蒿素和双氢青蒿素的说法不正确的
A.青蒿素的分子式为C15H22O5
B.青蒿素和双氢青蒿素不是同分异构体
C.青蒿素和双氢青蒿素都能发生酯化反应
D.青蒿素在稀硫酸催化条件下能发生水解反应
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.在蒸馏水中滴加浓H2S04,Kw不变
B.CaC03不易溶于稀硫酸,也不易溶于醋酸
C.NaCI溶液和CH3 COONH4溶液均显中性,两溶液中水的电离程度相同
D.在Na2S稀溶液中,c(H+) =c( OH-)-2c(H2S) -c(HS-)
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,则下列叙述正确的是
A.常温常压下,46g有机物C2H60中含有极性键的数目一定为7NA
B.标准状况下,22.4L四氯化碳中所含有的共价键数目一定为4NA
C.常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数一定为3NA
D.标准状况下,22.4L甲烷与22.4L氯气在光照时充分反应,生成的CH3Cl分子数一定为NA
难度: 中等查看答案及解析
-
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,其负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是
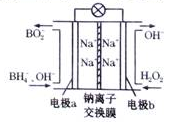
A.该电池的负极反应为BH4 +8OH- -8e-=BO2-+6H2O
B.电池放电时Na+从b极区移向a极区
C.每消耗3mol H2O2,转移的电子为3mol
D.电极a采用Mn02作电极材料
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、M的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,z的单质能溶于w的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A.元素W的气态氢化物与M的单质可发生置换反应
B.离子半径的大小顺序为W>M>Z>X>Y
C.元素Z、M的单质在一定条件下均能和强碱溶液反应
D.元素X与Y可以形成5种以上的化合物
难度: 中等查看答案及解析
-
某无色溶液中可能含有①Na+②Ba2+③Cl-④Br -⑤S042-⑥SO32-中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
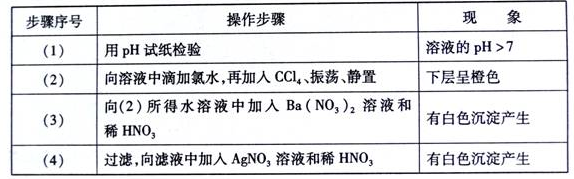
下列结论正确的是
A.不能确定的离子是① B.不能确定的离子是②③
C.肯定含有的离子是①④⑥ D.肯定没有的离子是②⑤
难度: 中等查看答案及解析
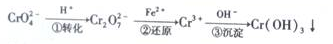



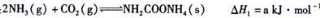
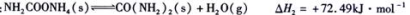
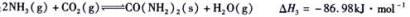
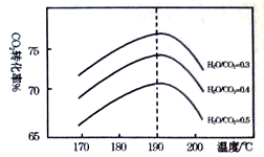
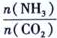 )对C02的转化率也有影响,若开始以氨碳比等于3进行总反应,达平衡时NH3的转化率为40%,则C02的平衡转化率为
)对C02的转化率也有影响,若开始以氨碳比等于3进行总反应,达平衡时NH3的转化率为40%,则C02的平衡转化率为