-
氯化亚铜广泛应用于有机合成、染料、颜料、催化剂等工业。氯化亚铜(CuCl)是一种白色粉末,微溶于水、不溶于乙醇、稀硝酸及稀硫酸;可溶于氨水、浓盐酸,并生成配合物NH4[CuCI2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。

实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36qo盐酸15mL、水。
(1)反应①的化学方程式为__________,用95%乙醇代替蒸馏水洗涤的主要目的是 。
(2)本实验中通入O2的速率不宜过大,为便于观察和控制产生02的速率,宜选择下图中的 (填字母序号)方案。

(3)实验开始时,温度计显示反应液温度低于室温,主要原因是 ;电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色;当时停止通入氧气,打开瓶塞,沿 (填字母)口倾出棕色反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题有 。
(5)氯化亚铜的定量分析:
①称取样品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;玻璃珠的作用是 。
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0mol.L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。

④数据处理:计算得CuCI的纯度为 (平行实验结果相差不能超过0.3%)
-
(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:
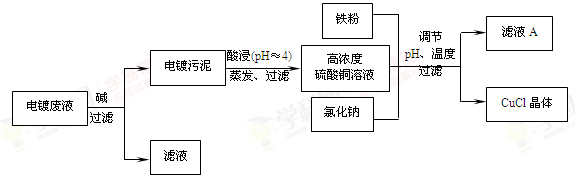
请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
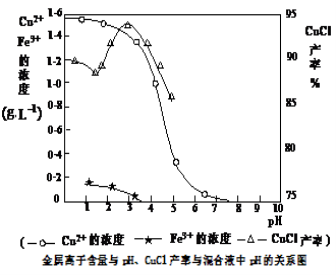
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
-
(15分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
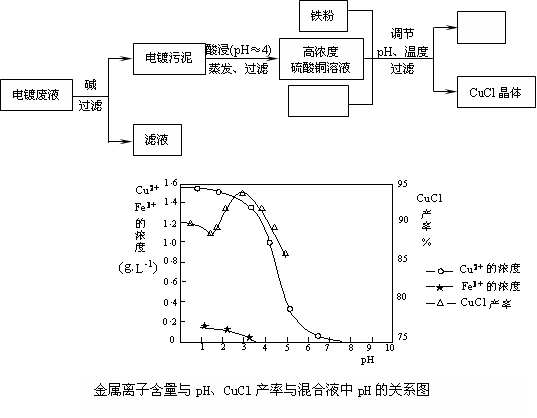
请回答下列问题:
(1)电镀污泥的主要成分是________(写化学式);
(2)酸浸时发生反应的离子方程式是________;
(3)析出CuCl晶体时的最佳pH在________左右;
(4)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
________;
(5)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是________。
-
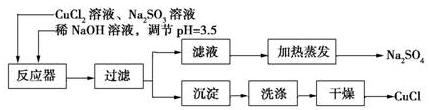
氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:
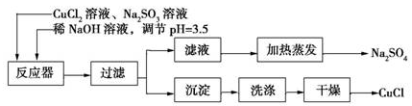
(1)上述方法制备氯化亚铜的化学方程式为_________________ 。
。
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。
(3)洗涤产品氯化亚铜沉淀的试剂是___________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收 一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
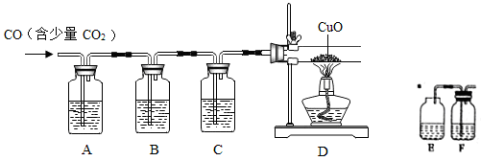
装置A中盛装的是饱和NaOH溶液,该装置的作用是_____________,装置B盛有澄清的石灰水,其中装置B的作用是___________,盛装CuCl的盐酸溶液的装置是____________(选填装置中提供的装置字母代号)。
-
氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:
(1)上述方法制备氯化亚铜的化学方程式为_________________。
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。
(3)洗涤产品氯化亚铜沉淀的试剂是____________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。

装置A中盛装的是饱和NaOH溶液,该装置的作用是______________,装置B盛有澄清的石灰水,其中装置B的作用是_____________,盛装CuCl的盐酸溶液的装置是__________(选填装置中提供的装置字母代号)。
-
CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
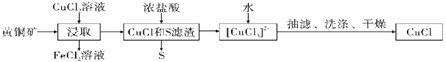
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq) [CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
[CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
A.浸取阶段,参加反应的CuFeS2和CuCl2的物质的量之比为3:l
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq) [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuCl
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
-
CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
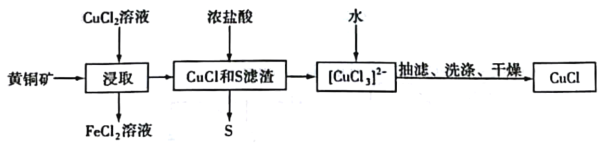
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)⇌[CuCl3]2-(aq)(无色溶液)。下列叙述正确的是
A.“浸取”过程中的主要反应为CuFeS2+4CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s) +2Cl-(aq)⇌[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度增大
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
-
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
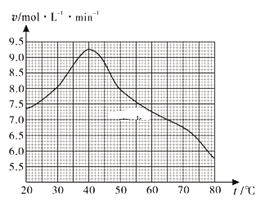
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为______。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是__________。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2 g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为_______,所得溶液的物质的量浓度为______。
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需___________________。
-
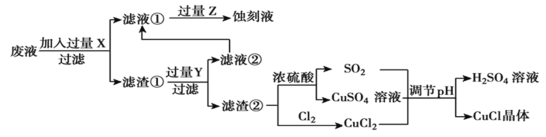
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含 、
、 、
、 、
、 )生产CuCl的流程如图所示:
)生产CuCl的流程如图所示:
根据以上信息回答下列问题:
(1)生产过程中:X是______。(填化学式)
(2)写出生成CuCl的离子方程式______。
(3)析出的CuCl晶体不用水而用无水乙醇洗涤的原因是____。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是___________。
(5)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 mol∙L-1的CuCl2溶液中加入足量的铜,能否生成CuCl?(通过计算说明)_________。
(6)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g)  CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A 降低温度 B 增大压强 C 延长反应时间 D 把CuCl分散到疏松多孔的分子筛中
(7)已知:CuCl Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl- CuCl2- K2;则反应Cu++2Cl-
CuCl2- K2;则反应Cu++2Cl- CuCl2-的平衡常数K=_______(用K1、K2表示)。
CuCl2-的平衡常数K=_______(用K1、K2表示)。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如图所示:
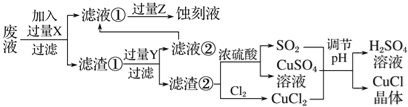
根据以上信息回答下列问题:
(1)写出生产过程中X________;Y________(填化学式)。
(2)析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________________;生产过程中调节溶液的pH不能过大的原因是________________________。
(3)写出生成CuCl的化学方程式:__________________________________。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是_________________。
(5)已知:常温下Ksp(CuCl)=1.6×10-7,Ksp(CuI)=1.2×10-12,现向CuCl饱和溶液中加入NaI固体至c(I-)=0.1mol/L,此时溶液中c(Cu+)/c(Cl-)=________。
(6)氯化亚铜的定量分析
①称取样品0.25 g置于已放入10 mL过量的FeCl3溶液的锥形瓶中,不断摇动。
②待样品溶解后,加水50 mL,邻菲罗啉指示剂2滴。
③立即用0.10 mol·L-1硫酸铈标准溶液滴定至终点,同时做空白实验一次。
已知:
CuCl+FeCl3===CuCl2+FeCl2;Fe2++Ce4+===Fe3++Ce3+。
如此再重复2次测得:
| 1 | 2 | 3 |
| 空白实验消耗硫酸铈 标准溶液的体积/mL | 0.75 | 0.50 | 0.80 |
| 0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.65 | 25.75 | 24.90 |
④数据处理:计算得CuCl的纯度为_________(平行实验结果相差不能超过0.3%)。
















