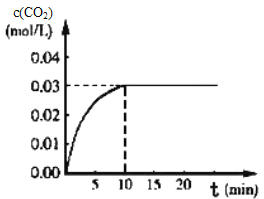
-
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
选项
实验目的
主要仪器
试剂
A
分离Br2和CCl4混合物
分液漏斗、烧杯
Br2和CCl4混合物、蒸馏水
B
鉴别葡萄糖和蔗糖
试管、烧杯、酒精灯
葡萄糖溶液、蔗糖溶液、银氨溶液
C
实验室制取H2
试管、带导管的橡皮塞
锌粒、稀HNO3
D
测定NaOH溶液浓度
滴定管、锥形瓶、烧杯
NaOH溶液,0.1000mol/L盐酸
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法不正确的是
A. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11.2L乙醇完全燃烧生成CO2的分子数目为0.5NA
B. 1LpH=1的CH3COOH溶液中,H+的数目小于0.1NA
C. Na2O2和CO2反应后固体质量增加42g,转移的电子数目为1.5NA
D. 足量的Fe与71gCl2充分反应,转移的电子数目为3NA
难度: 中等查看答案及解析
-
下列事实能说明醋酸是弱电解质的是( )
①醋酸与水能以任意比互溶;
②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子;
④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出C02;
⑥0.1mol/L醋酸钠溶液pH=8.9;
⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
⑧pH=a的溶液的物质的量浓度等于pH=a+1的溶液的物质的量浓度的10倍
A. ③④⑥⑦ B. ③④⑤⑥ C. ②⑥⑦⑧ D. ③④⑦⑧
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. c(H+)/c(0H-)=1012 的溶液中:NH4+、Al3+、NO3-、Cl-
B. pH=1 的溶液中:Fe2+、NO3-、SO42-、Na+
C. 由水电离的c(H+)=1×10-14mol·L-1 的溶液中:Ca2+、K+、Cl-、HCO3-
D. c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
汉黄苳素是传统中草药黄苳的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是()
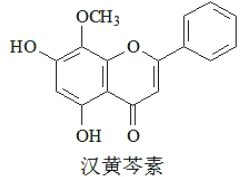
A. 汉黄苳素的分子式为C16H13O5
B. 该物质遇FeCl3溶液显色
C. 1mol该物质与溴水反应,最多消耗lmolBr2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
难度: 中等查看答案及解析
-
已知FeCl3溶液与KSCN溶液混合后发生反应FeCl3+3KSCN
Fe(SCN)3+3KCl,达到平衡后,改变条件,则下列说法正确的是
A. 向溶液中加入少许KC1固体,溶液颜色变浅
B. 升高温度,平衡一定发生移动
C. 加入少许KC1固体或者加入少许FeCl3固体平衡常数均发生变化,且变化方向相反
D. 平衡常数表达式为K=c[Fe(SCN)3]·c3(KCl)/[c(FeCl3)·c3(KSCN)]
难度: 中等查看答案及解析
-
准确移取20.00mL某待测HC1溶液于锥形瓶中,用0.1000mol·L-1NaOH溶液滴定,下列说法正确的是
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
C. 随着NaOH溶液滴入,锥形瓶中溶液pH由大变小
D. 碱式滴定管滴定前准确读数,滴定达终点时,俯视读数,则测定结果偏小
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列说法正确的是
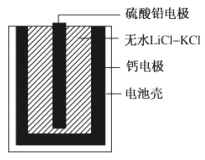
A. 放电过程中,Li+向负极移动
B. 正极反应式:Ca+2Cl-—2e-=CaCl2
C. 每转移0.1mol电子,理论上生成10.35gPb
D. 常温时,在正负极间接上电流表或检流计,指针偏转
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)反应达到平衡时,c(H2)=0.5mol.L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
A. 9 B. 16 C. 20 D. 25
难度: 中等查看答案及解析
-
从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
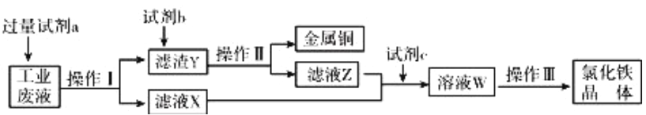
则下列说法正确的是( )
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为:2Fe2++Cl2=2Cl-+2Fe3+
D. 用酸性KMn04溶液可检验溶液W中是否还有Fe2+
难度: 中等查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下[已知N2(g)十3H2(g)
2NH3(g) △H=-92.4kJ/mol];下列说法正确的是( )
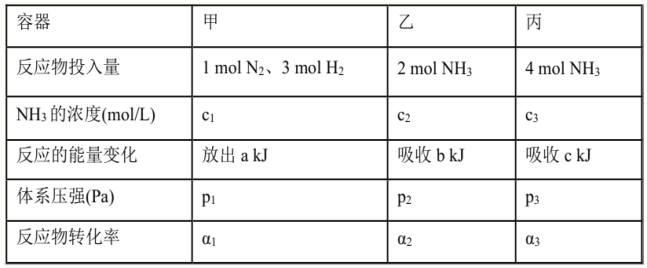
A. 2c1>c3 B. a+b>92.4 C. 2p2<p3 D. α1+α3<1
难度: 困难查看答案及解析
-
部分弱酸的电离常数如下表:

下列有关说法正确的是( )
A. 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
B. 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN
C. NaHS溶液中加入适量 KOH后:c(Na+)=c(H2S)+c(HS-)+2c(S2-)
D. HCOO-、CN-、HS-在溶液中不可以大量共存
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X和W同主族且W的单质是重要的半导体材料,Y原子的最外层电子数是其内层电子数的3倍,Z2+与Y2-核外电子排布相同。下列说法正确的是
A. X的氢化物中仅含有极性键
B. X与Y形成的三原子分子的电子式是
C. 原子半径Z>Y,离子半径Z2+< Y2-
D. X、Y的非金属性强弱可用其氧化物的水化物的酸性强弱来推断
难度: 中等查看答案及解析
-
室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
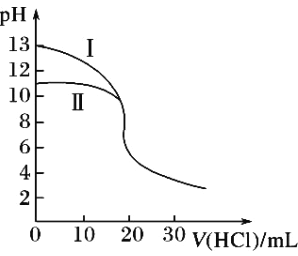
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
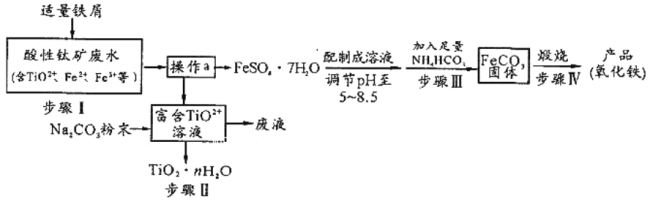
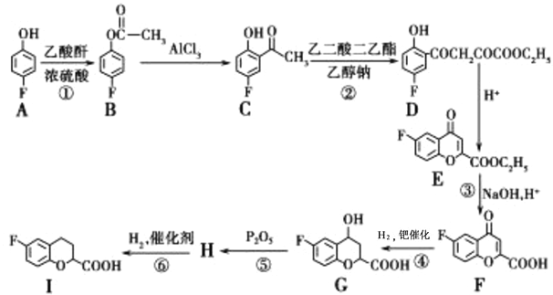
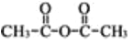
 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图(无机试剂任选)__________。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)__________。合成路线流程图示例如下: