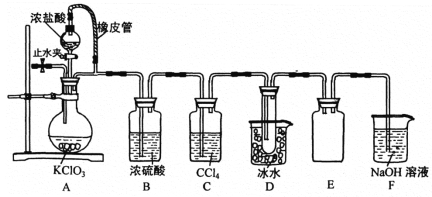
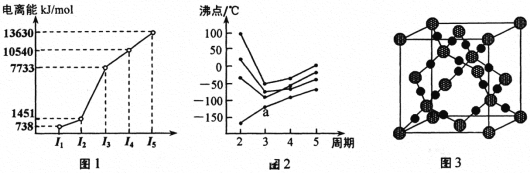
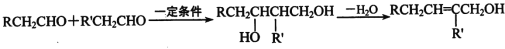-
化学与生产、生活密切相关。下列说法正确的是
A. 为防止月饼等富脂食品因被氧化而变质,常在包装袋中放入硅胶
B. 氯水和食盐水消毒杀菌的原理相同
C. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D. 燃煤中加入生石灰可以减少酸雨的形成及温室气体的排放
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 30g冰醋酸和葡萄糖的混合物中含氢原子的数目为2NA
B. 在12. 0 gNaHSO4晶体中,所含离子数目为0.3NA
C. 足量的镁与浓硫酸充分反应,放出 2.24L混合气体时,转移电子数为0.2NA
D. 标准状况下,11.2L乙烯和丙烯混合物中含氢原子数目为2NA
难度: 中等查看答案及解析
-
下列实验方案能达到实验目的的是
选项
实验目的
实验方案
A
验证海带中含有碘元素
将海带剪碎,加蒸馏水浸泡,取滤液滴加几滴稀硫酸和1 mLH2O2,再加入几滴淀粉溶液,观察溶液颜色的变化
B
探究化学反应的限度
取5mL0.1mol/L的KI溶液,滴加0.1mol/LFeC13溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
C
检验淀粉是否水解
向淀粉溶液中加入稀H2SO4,加热一段时间,冷却后加入新制Cu(OH)2,煮沸,观察是否有砖红色沉淀生成
D
比较Cu(OH)2、Mg(OH)2的Ksp相对大小
向2mL0.1mol/L的 MgSO4溶液中加入2mL0.2mol/LNaOH溶液,再滴加5~6滴0.1mol/LCuSO4溶液,观察沉淀的生成及其颜色的变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、R、T 的原子序数依次增大, X 的最外层电子数与次外层电子数相等, X、 W位于同族。Y和Z的价电子数之和等于R和T的最外层电子数之和,这四种元素组成两种盐Z2TY3和ZRY2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是
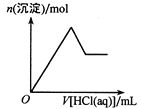
A. 简单离子的半径:r(Y)<r(Z)<r(W)
B. 气态氢化物的热稳定性: T > Y
C. 工业上电解R的氯化物冶炼单质R
D. X的氢氧化物既可与强酸反应,又可与强碱反应
难度: 困难查看答案及解析
-
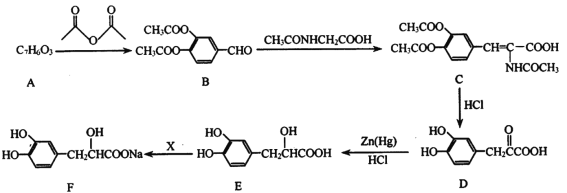
对有机物:
 的下列说法中正确的是
的下列说法中正确的是A. 含有4 种官能团
B. 该有机物的分子式为 C13H12O9
C. 该物质酸性条件下水解的有机产物只有1种
D. 该有机物能发生氧化反应、取代反应、加成反应、消去反应
难度: 简单查看答案及解析
-
溶于海水的CO2主要以4种无机碳形式存在,其中 HCO3-占95 % ,利用图示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法正确的是
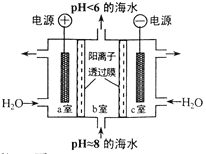
A. a 室排出的是NaOH 、Ca(OH)2等强碱性物质
B. b 室发生主要反应: 2H++ CO32-=== H2O +CO2↑
C. c室发生的反应为 2H2O-4e-===O2↑+ 4H+
D. 装置中产生的 O2和提取的 CO2的体积比约为1:4
难度: 中等查看答案及解析
-
室温下, 0.1 mol/L的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随pH 变化的关系如图所示。下列说法正确的是
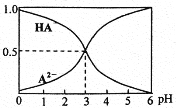
A. H2A 的电离方程式:H2A
H+ + HA-
B. pH = 5 时,在NaHA和Na2A的混合溶液中: c(HA-) : c(A2-)= 1 : 100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. NaHA溶液显碱性
难度: 困难查看答案及解析