-
氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品
(1)已知:25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10−4 | Ka1=6.17×10−8 、Ka2=2.88×10−12 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_________pH(NaHN2O2)(填“>”“<”或“=”)。
②25℃时,NaHN2O2溶液中存在水解平衡,其水解常数Kh=____(保留三位有效数字)。
③0.1mol/L NaHN2O2溶液中离子浓度由大到小为:________________________________
(2)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g) NH2CO2NH4(s) ΔH1=−159.5 kJ·mol−1;
NH2CO2NH4(s) ΔH1=−159.5 kJ·mol−1;
反应II:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol−1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5 kJ·mol−1;
反应III:H2O(l) H2O(g) ΔH3=+44.0 kJ·mol−1。
H2O(g) ΔH3=+44.0 kJ·mol−1。
则反应IV:NH3与CO2合成尿素同时生成液态水的热化学方程式为__________________。
(3)T1℃时,向容积为2 L的恒容密闭容器中充入n(NH3)∶n(CO2)=2∶1的原料气,使之发生反应IV,反应结束后得到尿素的质量为30 g,容器内的压强(p)随时间(t)的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为______________。
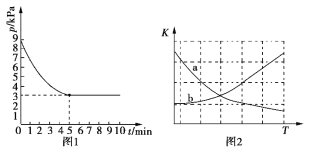
②图2中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母)。
-
氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_____pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=_______(保留三位有效数字)。
③0.lmol/LNa2N2O2溶液中离子浓度由大到小的顺序为____________。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g) NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
反应II:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为____________。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为___________。
②图2中能正确反应平衡常数K随温度变化关系的曲线为__________(填字母标号)。

(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为______________。
-
氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I: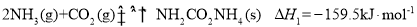
反应Ⅱ: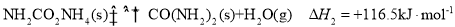
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应: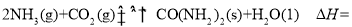 __________kJ/mol
__________kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应 ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
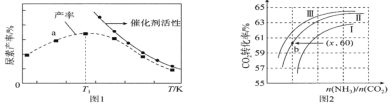
①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比 、水碳比
、水碳比 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
③已知该反应的 ,
, ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
 ;
;

①25℃时,向N2H4水溶液中加入H2SO4,欲使 ,同时
,同时 ,应控制溶液pH范围_____________(用含a、b式子表示)。
,应控制溶液pH范围_____________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
-
二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③ H2O(1) = H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为 ,请用化学反应速率和化学平衡理论解释其原因: 。
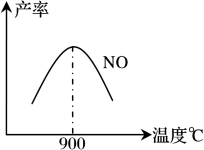
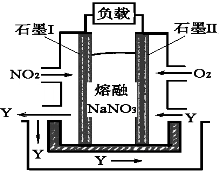
图1 图2
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________。
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显__________(填“酸性”、“中性”或“碱性”);计算反应NH4++HCO3—+H2O NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
-
二氧化碳和氨是重要的化工产品,是纯碱工业、制造硝酸、铵盐和氮肥等的原料。
(1)CO2的电子式是 。
(2)以NH3与CO2为原料合成尿素[化学式为CO(NH2)2]的主要反应如下:
① 2NH3(g)+CO2(g) = NH2CO2NH4(s) △H=-l59.5 kJ·mol-1
② NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③ H2O(1) = H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905kJ·mol-1
4NO(g)+6H2O(g) △H=-905kJ·mol-1
不同温度下NO产率如下图1所示,由此图可知温度对NO产率的影响规律为 ,请用化学反应速率和化学平衡理论解释其原因: 。
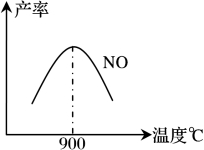
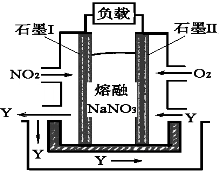
图1 图2
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关石墨I电极反应可表示为_______________。
(5)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11。 常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显__________(填“酸性”、“中性”或“碱性”);计算反应NH4++HCO3—+H2O NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
NH3·H2O+H2CO3的平衡常数K= (结果保留2位有效数字)。
-
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) △H=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1)=H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。
N2(g)+CO2(g) △H=Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。
-
水合肼作为一种重要的精细化工原料,在农药、医药及有机合成中有广泛用途。用尿素法制备水合肼,可分为两个阶段,第一阶段为低温氯化阶段,第二阶段为高温水解阶段,总反应方程式为:(NH2)2CO +NaClO+2NaOH → H2N—NH2·H2O+NaCl+Na2CO3。
主要副反应:N2H4+2NaClO= N2↑+2H2O+2NaCl △H<0
3NaClO=" 2NaCl" +NaClO3 △H>0
CO(NH2)2 +2NaOH= 2NH3↑+Na2CO3 △H>0
【深度氧化】:(NH2)2CO+3NaClO= N2↑+3NaCl+CO2↑+2H2O △H<0
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2。
步骤2.静置后取上层清液,检测NaClO的浓度。
步骤3.倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液。
步骤4.称取一定质量尿素配成溶液,置于冰水浴。将一定体积步骤3配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中,0.5h左右滴完后,继续搅拌0.5h。
步骤5.将步骤4所得溶液,加入5g KMnO4作催化剂,转移到三口烧瓶(装置见图),边搅拌边急速升温,在108℃回流5 min。
步骤6.将回流管换成冷凝管,蒸馏,收集( 108~114℃)馏分,得产品。
(1)步骤1温度需要在30℃以下,其主要目的是________。
(2)步骤2检测NaClO浓度的目的是________。
a.确定步骤3中需NaClO溶液体积及NaOH质量
b.确定步骤4中冰水浴的温度范围
c.确定步骤4中称量尿素的质量及所取次氯酸钠溶液体积关系
d.确定步骤5所需的回流时间
(3)尿素法制备水合肼,第一阶段为反应________(选填:“放热”或“吸热”)。
(4)步骤5必须急速升温,严格控制回流时间,其目的是________。
(5)已知水合肼在碱性条件下具有还原性(如:N2H4+2I2=N2+4HI)。测定水合肼的质量分数可采用下列步骤:
a.准确称取2.000g试样,经溶解、转移、定容等步骤,配制250mL溶液。
b.移取l0.00 mL于锥形瓶中,加入20mL水,摇匀.
c.用0.l000 mol/L碘溶液滴定至溶液出现微黄色且Imin内不消失,计录消耗碘的标准液的体积。
d.进一步操作与数据处理
①滴定时,碘的标准溶液盛放在________滴定管中(选填:“酸式”或“碱式”)。
②若本次滴定消耗碘的标准溶液为18.00mL,可测算出产品中N2H4-H2O的质量分数为________。
③为获得更可靠的滴定结果,步骤d中进一步操作主要是:________
-
水合肼是一种重要的精细化工原料,纯品为无色透明的油状液体,在高温下分解,水合肼具有还原性,在农药、医药及有机合成中有广泛用途。
用尿素法制备水合肼,反应方程式为:CO(NH2)2+NaClO+2NaOH=N2H4•H2O+NaCl+Na2CO3
实验步骤:
步骤1.向30%的NaOH溶液中通入Cl2,保持温度在30℃以下,至溶液显浅黄绿色停止通Cl2.静置,检测NaClO的浓度后,倾出上层清液,配制所需浓度的NaClO和NaOH的混合溶液.
步骤2.称取一定质量尿素配成溶液,置于冰水浴.将一定体积步骤1配得的溶液倒入分液漏斗中,慢慢滴加到尿素溶液中(如图),0.5h左右滴完.
步骤3.在三口烧瓶(见图)中加入5g KMnO4作催化剂,急速升温,在108℃回流5min,制取粗产品.
(1)配制30%的NaOH溶液需要的玻璃仪器有___________、__________和烧杯。
(2)用如图装置制取NaClO。
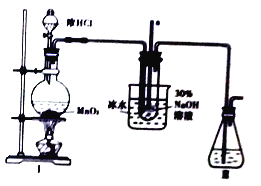
①Ⅱ中的导管a的作用是___________。
②已知3NaClO 2NaCl+NaClO3,Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是________。
2NaCl+NaClO3,Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是________。
③氯气中含有氯化氢,能降低NaClO产率,除去杂质气体的试剂是__________。
(3)步骤2中若将尿素滴加到NaClO中,降低水合肼的产率,原因是________(用化学方程式表示)。
(4)步骤1中检测NaClO浓度的目的是__________。
(5)N2H4有较强的还原性,在银的提取过程中有重要的应用,N2H4可以直接还原AgCl得到银单质,反应的化学方程式是____________。
-
氨气是一种重要的化工原料,在工农业中都有广泛的应用。
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入 与
与 合成尿素。在恒定温度下,混合气体中
合成尿素。在恒定温度下,混合气体中 的含量随时间的变化关系如图所示
的含量随时间的变化关系如图所示 该条件下尿素为固体
该条件下尿素为固体 。A点的正反应速率
。A点的正反应速率 ______ B点的逆反应速率
______ B点的逆反应速率 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于” ,
, 的平衡转化率为______。
的平衡转化率为______。
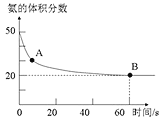
(2)氨基甲酸铵 是合成尿素过程中的中间产物。现将体积比为2:1的
是合成尿素过程中的中间产物。现将体积比为2:1的 和
和 混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:
混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡: 。实验测得在不同温度下的平衡数据如表:
。实验测得在不同温度下的平衡数据如表:
①上述反应的焓变: ______
______ 填“
填“ ”、“
”、“ ”或“
”或“ ”,下同
”,下同 ,熵变
,熵变 ______
______ 根据表中数据,列出
根据表中数据,列出 时该反应的化学平衡常数的计算式
时该反应的化学平衡常数的计算式 ______
______ 不要求计算结果
不要求计算结果 。
。
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将______ 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” 。
。
(3)向含 的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______
的溶液中滴加bL氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将______ 填“正向”、“不”或“逆向”
填“正向”、“不”或“逆向” 移动,所滴加氨水的浓度为______
移动,所滴加氨水的浓度为______  时,
时, 的电离平衡常数
的电离平衡常数 
-
乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为____________________________________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:__________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质),电石与水反应生成C2H2(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的热量,则该反应的热化学方程式为______________________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:
4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③电石法工艺流程简单、容易操作、乙炔纯度高,缺点是___________________(举1例)。
(3)甲烷裂解法原理为:2CH4(g) C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
C2H2(g)+3H2(g) △H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如下图所示:
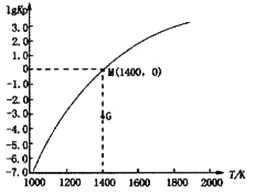
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,CH4、C2H2及H2的物质的量分别为a、b、c,则总压P与a、b、c之间的关系为___________________。
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
NH2CO2NH4(s) △H1=-159.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJ•mol-1;


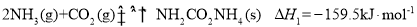
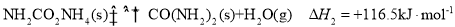
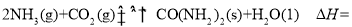 __________kJ/mol
__________kJ/mol








