-
碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) △H=-l59.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1)=H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。
N2(g)+CO2(g) △H=Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。
-
研究氮、硫及卤素(F、Cl、Br、I)等单质及其化合物的反应在工农业生产、日常生活和环境保护中有重要意义。
(1)工业上利用氨在催化剂存在的情况下与氧气反应来制备生产硝酸所需要的一氧化氮,该反应的化学方程式为 。NH3的电子式为 。硝酸生产过程中排放出来的一氧化氮是大气污染物之一,目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把一氧化氮还原成无色无毒气体,直接排入空气中,有关反应的化学方程式为 。
(2)已知在加热条件下浓硫酸能将木炭粉氧化,该反应的化学方程式为 。某学习小组设计实验来验证上述反应所产生的各种产物,将该反应生成的气体依次通过①装有无水硫酸铜的U型管 ②装有品红溶液的洗气瓶 ③装有酸性KMnO4溶液的洗气瓶 ④装有品红溶液的洗气瓶 ⑤装有澄清石灰水的烧杯,实验中能说明产物内含有CO2的现象是 。
(3)某学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。该小组设计的实验操作依次为:①向NaBr溶液中通入氯气 ②向KI溶液中通入氯气,若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是 (用离子方程式表示)。从原子结构的角度解释氯、溴、碘氧化性逐渐减弱的原因是 。
-
氨气是一种重要化合物,在工农业生产、生活中有着重要作用。
(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
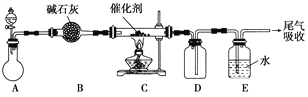
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是________。
②C装置中发生反应的化学方程式为________________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是________,试设计实验证明这种离子的存在_____________________。
④下列哪些装置可以同时起到装置D和E的作用________(填代号)。
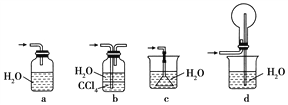
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________________(不必配平),该反应生成的还原产物的化学键类型是________。
-
氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
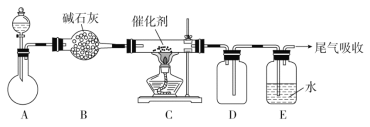
①检查装置气密性的方法是__________________________,D的作用是________。
A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是________(填化学式)。
②反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是____________,试设计实验证明这种离子的存在:__________________________________________。
③下列哪个装置可以同时起到装置D和E的作用________(填代号)。
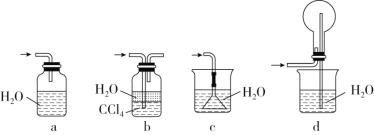
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________________________,该反应生成的还原产物的化学键类型是________。
-
氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
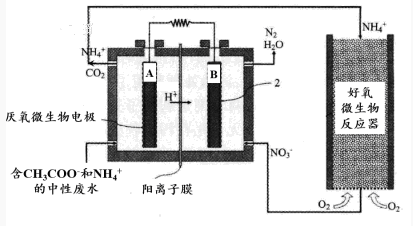
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
-
氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。

① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
-
氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是________。
② 氨催化氧化生成一氧化氮反应的化学方程式是________。
(1)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图:
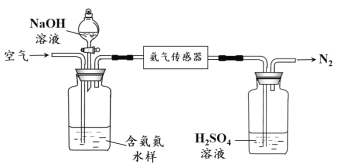
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol·L-1,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。

① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:________。
② 用化学用语简述NH4+去除的原理:________。
-
氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是________。
② 氨催化氧化生成一氧化氮反应的化学方程式是________。
(1)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图:
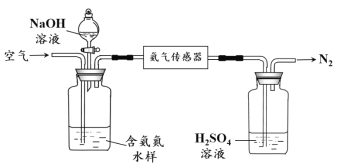
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol·L-1,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
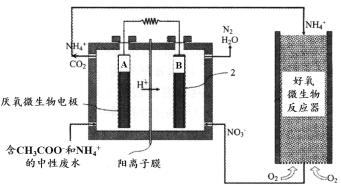
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:________。
② 用化学用语简述NH4+去除的原理:________。
-
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐 和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
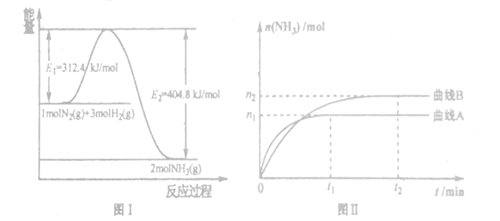
下列说法正确的是_______。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 mol/(L·min)
mol/(L·min)
(3) —定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时 测得容器的压强为起始时的 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(4)已知H2(g)的燃烧热为285.8 kJ/mol,试写出表示NH3(g)燃烧热的热化学反应方程式 _____。以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为_______经測定,该电作过程中每放出1 mol N2实际提供460 kJ的电能,则该燃料电池的实际效率为_____(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数)
-
氨是氮循环中的重要物质,在生产、生活和科研中有着广泛的应用.
(I)工业上利用氨来制备生产硝酸赝蔼要的一氧化氮,该反应的化学方程式为________
已知:Ⅰ.2NN3(g)+CO2(g)⇌NH2CO2NH4(s)△H=-159.47kJ•mol-1
Ⅱ.2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H=-42.98kJ•mol-1
①反应NH2CO2NH4(s)⇌CO(NH2)2(s)+H2O(g)的△H=________
②一定条件下在密闭容器中发生反应Ⅰ,平衡后只改变一个条件.导致化学平衡常数变小,下列说法正确的是________(填序号).
a.改变的条件一定是减小压强
b.改变的条件一定是升高温度
c.反应速率减小,平衡一定向正反应方向移动
d.反应速率增大,平衡一定向逆反应方向移动
③-定条件下,将2molNH3和ImolC02充入容积为2L的密闭容器中发生反应Ⅱ.反应进行2min时,产生热量21.49kJ,则2min内该反应的反皮速率v(NH3)=________,此条件下该反应的化学平衡常数K=________.
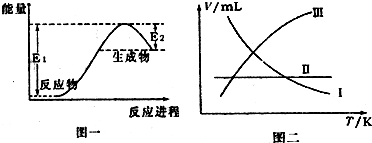
(3)图一为实验室制备NH3的能量变化图象,图二中的曲线表示产生氨气的体积随温度的变化趋势,其中正确的是________ (填写代号).
N2(g)+CO2(g) △H=Q kJ·mol-1。













