-
下列有关乙烯的说法错误的是
A. 在常温常压下为气体 B. 是一种植物生长调节剂
C. 可自身加成形成聚乙烯 D. 不能使溴的CCl4溶液褪色
难度: 简单查看答案及解析
-
下列物质中,能使酸性高锰酸钾溶液褪色的是
A. 苯 B. 乙烯 C. 甲烷 D. 乙烷
难度: 简单查看答案及解析
-
下列过程中所发生的化学反应,不属于取代反应的是
A. 光照射甲烷与氯气的混合气体
B. 苯与液溴混合后撒入铁粉
C. 在镍作催化剂的条件下,苯与氢气反应
D. 加热至50~60℃,在浓硫酸作用下,苯与浓硝酸反应
难度: 简单查看答案及解析
-
下列关于乙醇、乙酸的说法中,不正确的是
A. 乙醇不能与金属钠反应
B. 乙醇在空气中燃烧时放出大量的热
C. 乙酸能与CaCO3反应放出CO2
D. 在浓硫酸存在下,加热,乙酸与乙醇发生酯化反应
难度: 简单查看答案及解析
-
LED即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是
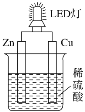
A. 装置中存在“化学能→电能→光能”的转化
B. 铜片上发生的反应为2H++2e-=H2↑
C. 锌片是负极,其质量逐渐减小
D. 如果将稀硫酸换成稀盐酸,则导线中不会有电子流动
难度: 简单查看答案及解析
-
下列液体中 pH>7的是
A. 蔗糖溶液 B. 人体血液 C. 胃液 D. 食盐水
难度: 简单查看答案及解析
-
用稀NaOH溶液与稀盐酸反应测定中和热的实验中,下列操作错误的是
A. 反应前酸、碱溶液的温度要相同
B. 测量混合溶液温度时,温度计插在溶液中
C. 为了使反应均匀进行,可以向酸中分多次加入碱
D. 为了使反应更完全,可以使碱适当过量
难度: 简单查看答案及解析
-
Mg(OH)2固体在水中达到溶解平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),为使Mg(OH)2固体的量减少,可加入少量的
A. NH4Cl B. NaOH C. MgSO4 D. Na2SO4
难度: 简单查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是
A. 开启啤酒后,瓶中马上泛起大量泡沫
B. 实验室中常用排饱和食盐水的方法收集Cl2
C. 加入催化剂有利于氨的合成
D. 生产硝酸中使用过量空气以提高氨的利用率
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 若将等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B. C(s,石墨)= C(s,金刚石) ΔH﹦+1.5kJ/mol,结论:相同条件下金刚石性质比石墨稳定
C. CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) △H﹦-801.3kJ/mol, 结论:CH4的燃烧热△H﹦-801.3kJ/mol
D. N2(g) + 3H2(g)
2NH3(g) ΔH﹦-92.4kJ/mol,结论:在密闭容器中充入0.5molN2、1.5molH2,充分反应后放出46.2kJ的热量
难度: 简单查看答案及解析
-
在催化条件下发生反应:N2O(g)+CO(g)
CO2(g)+N2(g)可使环境污染性气体转化为无害气体。反应进程中的能量变化如图所示。下列说法正确的是

A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g)
CO2(g)+N2(g) △H﹦ - 226 kJ/mol
C. 反应物的总能量小于生成物的总能量
D. 该反应正反应的活化能大于逆反应的活化能
难度: 简单查看答案及解析
-
用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
难度: 简单查看答案及解析
-
25℃时,关于pH=3的醋酸溶液和pH=11的NaOH溶液,下列说法不正确的是
A. c(Na+)= c(CH3COO-)
B. 醋酸溶液中c(H+)等于NaOH溶液中c(OH-)
C. NaOH溶液的导电能力比醋酸溶液的强
D. 将两溶液等体积充分混合,所得溶液呈酸性
难度: 简单查看答案及解析
-
将4molSO2和2mol O2在2L的恒容密闭容器中混合,并在一定条件下发生如下反应: 2SO2(g)+ O2(g)
2SO3(g),若经2s后测得SO3的浓度为0.6mol/L。下列说法中不正确的是
A. 用SO2表示反应的平均速率为0.3mol/( L·s)
B. 用O2表示反应的平均速率为0.15mol/(L.s)
C. 2s时O2的浓度为0.7mol/L
D. 2s时SO2的转化率为70%
难度: 简单查看答案及解析
-
已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
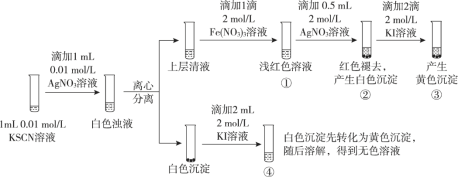
下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
难度: 中等查看答案及解析
-
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)
PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl3(g)
Cl2(g)
PCl5(g)
初始浓度/(mol·L-1)
2.0
1.0
0
平衡浓度/(mol·L-1)
c1
c2
0.4
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/( L·min)
B. 升高温度,反应的平衡常数增大
C. 反应达到平衡时容器内的压强与初始时容器的压强之比为13:15
D. 平衡后移走2.0 mol PCl3和1.0 mol Cl2,相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1
难度: 中等查看答案及解析
-
工业上合成CH3OH的原理为:2H2(g)+CO
CH3OH(g),一定温度下,向1L恒容密闭容器中充入H2和CO,反应达平衡时CH3OH的体积分数与反应物投料之比(n(H2)/n(CO))的关系如图所示。下列说法错误的是
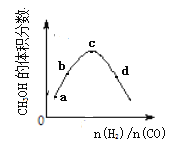
A. 相同条件下,达到平衡时混合气体的密度与反应前相同
B. a、b、c、d四点中,c点CO的转化率最大。
C. 若投料时n(CO)不变,a、b、c、d四点中d处CH3OH的物质的量最大
D. 图像中 c点到d点,平衡向正反应方向移动
难度: 中等查看答案及解析
-
—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+ 6H2(g)
C2H5OH(g)+3H2O(g)达平衡。下列说法正确的是
容器
温度/K
物质的起始浓度(mol·L-1)
物质的平衡浓(mol·L-1)
CO2(g)
H2(g)
C2H5OH(g)
H2O(g)
C2H5OH(g)
甲
500
0.20
0.60
0
0
0.083
乙
500
0.40
0.60
0
0
丙
600
0
0
0.10
0.30
0.039
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(C2H5OH ,甲)﹦c(C2H5OH ,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
难度: 中等查看答案及解析
-
25℃时,将一元酸HA的溶液和KOH溶液等体积混合(设混合后溶液体积等于混合前两溶液体积之和),所得实验数据如下表:
实验编号
起始浓度/(mol·L-1)
反应后溶液的pH
HA
KOH
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是
A. 实验①反应后的溶液中:c(K+)+ c(H+)-c(A-)=1×10-9 mol·L-1
B. 实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
C. 实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D. 实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
难度: 中等查看答案及解析
-
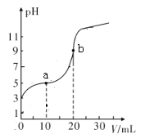
已知:电导率越大导电能力越强。25℃时,用0.100 mol/L NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol/L的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示(注:混合后溶液体积等于混合前两溶液体积之和)。下列说法正确的是
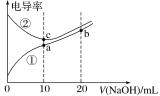
A. 曲线①代表滴定盐酸的曲线
B. a点溶液中:c(OH-)+c(CH3COO-)-c(H+)=0.1mol/L
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
难度: 中等查看答案及解析