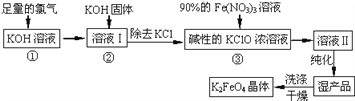
-
把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片完全溶解,经分析该溶液中无Fe3+,且生成的Fe2+与反应生成的H2的物质的量之比为3︰1,则原混合物中Fe2O3与Fe的物质的量之比为( )
A. 1︰1 B. 2︰5 C. 4︰1 D. 3︰1
难度: 中等查看答案及解析
-
铁、铜混合粉末18.0 g加入到100 mL 5.0 mol·L-1 FeCl3 溶液中,剩余固体质量为3.2 g。下列说法正确的是( )
A. 剩余固体是铁、铜混合物 B. 原固体混合物中铜的质量是9.6 g
C. 反应后溶液中n(Fe3+)=0.10 mol D. 反应后溶液中n(Fe2+)+n(Cu2+)=0.5 mol
难度: 困难查看答案及解析
-
纯碱在玻璃、肥皂、造纸、食品等工业中有广泛的应用,纯碱属于
A. 酸 B. 碱 C. 盐 D. 氧化物
难度: 简单查看答案及解析
-
金属加工后的废切削液中含2—5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:
第一步:NaNO2+NH4Cl=NaCl+NH4NO2第二步:NH4NO2= N2↑+2H2O
下列对第二步反应的叙述中正确的是( )
①NH4NO2是氧化剂 ② NH4NO2是还原剂 ③ NH4NO2发生了分解反应
④只有氮元素的化合价发生了变化 ⑤ NH4NO2既是氧化剂又是还原剂
A. ①③ B. ①④ C. ②③④ D. ③④⑤
难度: 中等查看答案及解析
-
国产自主研发芯片麒麟970是全球首款内置神经网络单元的处理器,该处理器芯片中使用的材料是

A. 硅 B. 钛合金 C. 二氧化硅 D. 铅合金
难度: 简单查看答案及解析
-
在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。下列说法正确的是
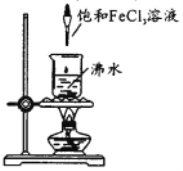
A. 用激光笔照射,会出现丁达尔效应
B. 将液体静置片刻,会出现沉淀现象
C. 所得胶体中分散质的粒子直径大于100nm
D. 可用滤纸分离提纯得到氢氧化铁胶体
难度: 简单查看答案及解析
-
下列解释事实的方程式不正确的是
A. 焊接铁轨:2Fe+Al2O3
2Al+Fe2O3
B. 人工固氮:N2+3H2
 2NH3
2NH3C. 用纯碱除油污:CO32-+H2O
HCO3-+OH-
D. 用湿润的淀粉KI试纸检验Cl2:Cl2+2I-=2Cl-+I2
难度: 中等查看答案及解析
-
下列反应的现象描述与离子方程式都正确的是( )
A. 金属镁与稀盐酸反应:有气泡逸出 Mg+2H++2Cl-===MgCl2+H2↑
B. 氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO42-===BaSO4↓
C. 碳酸镁与盐酸反应:有气泡逸出 CO32-+2H+===CO2↑+H2O
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生 2HCO3-+Ba2++2OH-===BaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
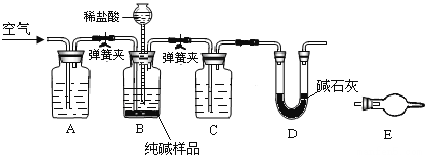
用下列实验装置进行相应实验,能达到实验目的的是
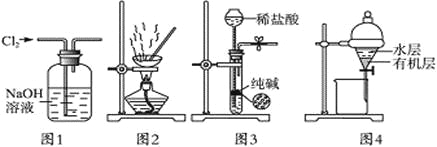
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
下列实验操作或事实与预期实验目的或所得结论对应正确的是( )
选项
实验操作或事实
实验目的或结论
A
淡黄色试液
红褐色沉淀
说明原溶液中一定含所有FeCl3
B
CaO
Ca(OH)2
NaOH
用生石灰制备NaOH溶液
C
新收集的酸雨
白色沉淀
酸雨中一定含有SO42-
D
H3PO3+2NaOH(足量)=Na2HPO3+2H2O
H3PO3属于三元酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将一定量CO2通入NaOH溶液中,将充分反应后的溶液减压蒸发得到固体。下列对所得固体的成分说法中不正确的是
A.所得固体可能由NaOH和Na2CO3组成 B.所得固体可能由NaOH和NaHCO3组成
C.所得固体可能由Na2CO3和NaHCO3组成 D.所得固体可能只含有NaHCO3
难度: 中等查看答案及解析
-
向铝粉中添加少量NH4C1固体并充分混合,将其加热到1000℃时可与N2反应制备A1N,下列说法正确的是
A. A1N是一种金属材料
B. A1N与足量氢氧化钠溶液共热时生成氢氧化铝和氨气
C. 少量NH4C1能够破坏A1表面的Al2O3薄膜
D. A1N与足量盐酸反应的离子方程式为AlN+3H+=Al3++NH3↑
难度: 困难查看答案及解析
-
为了检验某氯化亚铁溶液是否变质,可向溶液中加入 ( )
A. 氢氧化钠溶液 B. 铁片 C. 硫氰化钾溶液 D. 紫色石蕊试液
难度: 简单查看答案及解析
-
用毛笔蘸取少量30% FeCl3溶液在铜片上写一个“Cu”字,放置片刻,用少量水将铜片上的溶被冲到小烧杯中,下列说法正确的是( )
A. 烧杯中的溶液呈黄色 B. 铜片无任何变化
C. 铜片上有凹陷的“Cu”字 D. 发生了反应:Fe3+ +Cu=Cu2++ Fe2+
难度: 中等查看答案及解析
-
由二氧化硅制高纯硅的流程如下,下列判断中错误的是( )
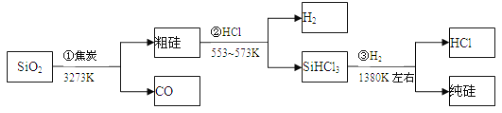
A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5 g
难度: 中等查看答案及解析
-
将一定量的某镁铝合金放入足量稀盐酸中,生成H2的体积在标准状况下为2240 mL,将相同量的该镁铝合金放入足量的NaOH溶液中,生成H2的体积在标准状况下为2016mL,则该合金中Mg、Al的质量之比是( )
A. 1:1 B. 6:1 C. 1:6 D. 4:27
难度: 简单查看答案及解析
-
某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是( )
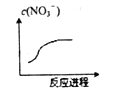
A. Cr2O72-中Cr化合价是+6 价 B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol D. 反应中Cr3+被氧化
难度: 中等查看答案及解析