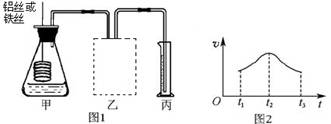
-
下列电离方程式正确的是
A.H2S
2H+ + S2- B. HF = H+ + F-
C.NaHSO3 = Na+ + H+ +SO32- D.H2CO3+ H2O
H3O+ + HCO3-
难度: 简单查看答案及解析
-
25℃时,pH=2的HCl溶液中,由水电离出的c(H+)浓度是
A.1×10-7mol·L-1 B.1×10-12mol·L-1
C.1×10-2mol·L-1 D.1×10-14mol·L-1.
难度: 简单查看答案及解析
-
下列物质的稀溶液中存在电离平衡的有(不考虑水的电离)
A.HBr B.NaHSO4 C.NH4NO3 D.NaHCO3
难度: 简单查看答案及解析
-
水的电离过程为H2O
H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随着温度升高而降低 B.在35℃时,c(H+)>c(OH-)
C.蒸馏水中通HCl,Kw增大 D.水的电离是吸热的
难度: 简单查看答案及解析
-
某学生用碱式滴定管量取0.1mol. L-1的NaOH溶液,开始时仰视液面,读数为11.00m L,取出部分溶液后俯视液面,读数为19.00m L,实际取出的体积为
A.大于8.00m L B.小于8.00m L C.等于8.00m L D.无法确定
难度: 简单查看答案及解析
-
已知;
,
则反应的△H为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
在盐类的水解过程中,下列各种情况必定发生的是
A.盐的电离平衡被破坏 B.水的电离平衡被破坏
C.25℃,溶液的pH不是7 D.溶液温度升高
难度: 简单查看答案及解析
-
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是
A.MgO B.MgCO3 C.NaOH D.Mg(OH)2
难度: 简单查看答案及解析
-
已知达到电离平衡的0.1mol/L的醋酸溶液中,为了促进醋酸的电离,同时使溶液的pH降低,应采取的措施是
A.加入一定量的水 B.加热溶液 C.加入少量盐酸 D.加入冰醋酸
难度: 简单查看答案及解析
-
100
时,若100体积 pH=a的某强酸溶液与1体积pH =b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是
难度: 简单查看答案及解析
-
下列各物质投入水中,因促进水的电离而使溶液呈酸性的是
A.HCl B.NaHSO4 C.Na2SO4 D.NH4Cl
难度: 简单查看答案及解析
-
氯化银在水中存在AgCl(s)
Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
A. ①②③④ B.③④①② C.①②④③ D.③④②①
难度: 简单查看答案及解析
-
下列事实不能用勒沙特列原理解释的是
A.用排饱和食盐水的方法收集氯气
B.在沸腾的蒸馏水中滴加FeCl3溶液,制Fe(OH)3胶体
C.在FeCl3溶液中加AgNO3溶液,产生白色沉淀
D.向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,白色固体转化为黑色固体
难度: 简单查看答案及解析
-
室温下,已知某溶液中由水电离出的c(H+)和c(OH-)浓度的乘积为10-24,则在该溶液中,一定不能大量存在的离子是[
A. SO32- B. HCO3— C. NH4+ D. NO3—
难度: 简单查看答案及解析
-
在常温下,10mLpH=10的KOH溶液中,加入pH=4的CH3COOH溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是
A.c(CH3COO-)< c (K+)
B.c(H+) = c(OH-)< c(K+)< c(CH3COO -)
C.V总 > 20mL
D.V总 < 20mL
难度: 简单查看答案及解析
-
下列说法正确的是
A. H2S的水溶液中,c(H+)与c(S2—) 之比为2:1
B. ( NH4)2SO4溶液中c(NH4+)与c(SO42—) 之比为2:1
C. 一定温度下,将SO3 (g)放入密闭容器中反应达到平衡后,n(SO2)与n(O2) 比为2:1
D. 相同温度下,1mol/L的醋酸溶液与0.5mol/L醋酸溶液中c(H+)之比为2:1
难度: 简单查看答案及解析
-
铅蓄电池效率低,污染大,目前正逐步被锌电池取代.锌电池的原料为锌、空气和电解质溶液,电池反应为2Zn+O2=2ZnO,下列关于锌电池的叙述中,正确的是
A.锌为负极,空气进入负极发生反应
B.正极发生氧化反应,负极发生还原反应
C.负极电极反应是:Zn – 2e- +2OH-=ZnO+H2O
D.电池工作时,溶液的pH变小
难度: 简单查看答案及解析
-
关于NaHCO3水溶液的表述正确的是
A.c (Na+)= c (HCO3-) + 2c (CO32-) + c (H2CO3)
B.c (OH-) + 2c (CO32-) + c (HCO3-) = c (H+) +c (Na+)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离平衡有:
NaHCO3
Na++HCO3—,HCO3—
H++CO32—,H2O
H++OH—
难度: 简单查看答案及解析
-
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(aq)
H+(aq) + In-(aq)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:
①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液
⑤NaHCO3溶液 ⑥氨水,
其中能使指示剂显红色的是
A.①④ B.②⑤⑥ C.①④⑤ D.②③⑥
难度: 简单查看答案及解析
-
等体积等物质的量浓度的NaCl和NaClO溶液,两份溶液中离子总数相比
A.前者多 B.后者多 C.一样多 D.无法判断
难度: 简单查看答案及解析
-
工业上制备纯硅反应的热化学方程式为:
SiCl4(g)+2H2(g)
Si(s)+4HCl(g);△H = +QkJ/mol (Q>0),一定温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A、反应过程中,若将硅移出体系,能提高SiCl4的转化率
B、若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C、反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03mol/(L
min)
D、当反应吸收热量为0.025QkJ时,生成的HCl通入100mL 1mol/L的NaOH溶液恰好完全反应
难度: 简单查看答案及解析
-
分别将下列物质:①CuSO4 ②Na2O2 ③NaCl ④FeCl3 投入水中,对其溶液加热蒸干,仍能得到原物质的是
A.①②③ B.①③ C.③④ D.③
难度: 简单查看答案及解析
-
放热反应CO(g)+H2O(g)
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
难度: 简单查看答案及解析
-
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图示,下列说法不正确的是
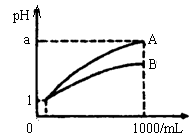
A.A、B两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
难度: 简单查看答案及解析
-
某温度下,在容积固定不变的密闭容器中发生下列可逆反应:X(g) + 2Y(g)
2Z(g)。
平衡时,X、Y、Z的物质的量分别为1 mol、1 mol、2 mol,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
A.刚充入时,反应速率V (正)减小,V (逆)增大
B.达到新平衡时,容器内气体的平均相对分子质量增大
C.达到新平衡时,容器内气体的压强是原来的两倍
D.达到新平衡时,容器内气体的百分组成和原来相同
难度: 简单查看答案及解析