-
下列叙述不正确的是
A. “84”消毒液可用作漂白剂 B. 过氧化钠可用作供氧剂
C. 医院常用90%的酒精作消毒剂 D. 活性铁粉可用作抗氧化剂
难度: 简单查看答案及解析
-
《新修本草》中有关于“靑矾”的描述:“本来绿色,新出窟未见风者,正如瑠璃……烧之赤色 ……”文中涉及的操作方法是
A. 分液 B. 灼烧 C. 升华 D. 干馏
难度: 简单查看答案及解析
-
下列生活用品中主要由合成纤维制造的是
A. 尼龙降落伞 B. 羊毛衫 C. 纯棉T恤 D. 餐巾纸
难度: 简单查看答案及解析
-
甲醛被视为“空气杀手”,可用如下方法检测:5HCHO+4MnO4-+12H+==4Mn2++5CO2+11H2O。下列说法不正确的是
A. 甲醛中存在极性键
B. CO2的电子式为
C. MnO4-是氧化剂,CO2是氧化产物
D. 当有1.8 g甲醛参加反应时,转移电子的物质的量为0.12mol
难度: 中等查看答案及解析
-
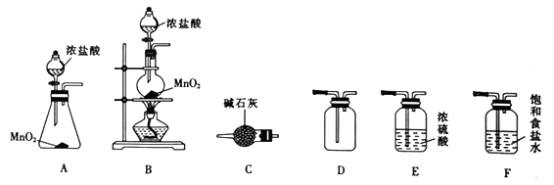
下列叙述正确的是

A. 用装置①来验证生铁片发生吸氧腐蚀 B. 用装置②来进行苯萃取碘水中I2的操作
C. 装置③中的读数为12.20 mL D. 用装置④来干燥、收集并吸收多余的氨气
难度: 中等查看答案及解析
-
向含有下列离子的溶液中加入相应试剂后,发生反应的离子方程式书写正确的是
选项
离子组
加入试剂
离子方程式
A
Al3+、SO42-
适量Ba(OH)2溶液
Al3++3OH-==A1(OH)3↓
B
Fe2+、I-
足量新制氯水
Cl2+2I-==2C1-+I2
C
Na+、NO3-
NaHSO3溶液
3SO32-+2 NO3-+2H+==3SO42-+2NO↑+H2O
D
Ba2+、HCO3-
少量Ba(OH)2溶液
Ba2+ + HCO3-+OH- ==BaCO3↓+H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化合物
(b)
(d)、CH
C—CH=CH2(p)的分子式均为C4H4。下列说法正确的是
A. b的同分异构体只有d和p两种 B. d的一氯代物和二氯代物均只有一种
C. b、d、p均可与酸性髙锰酸钾溶液反应 D. 只有b的所有原子处于同一平面
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是
A. pH=3的硫酸溶液中所含H+的数目为10-3NA
B. 7.8g Na2O2与足量SO2完全反应,转移的电子数为0. 1NA
C. 标准状况下,11.2 L丙烷中含有的共用电子对数目为5NA
D. 0.1mol NH3与0.1 mol HC1在密闭容器中充分反应后,气体的分子总数为0.1NA
难度: 中等查看答案及解析
-
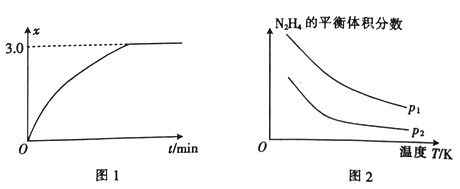
向一恒容密闭容器中充入一定量的NO和炭粉,使之发生反应:C(s)+2NO(g)
CO2(g)+N2(g)ΔH,平衡时c(NO)与温度T的关系如图所示。下列说法正确的是

A. ΔH>0
B. T2℃时,D点达到平衡时的平衡常数与B点的相等
C. 正反应速率:v(B)>v(D)>v(A)
D. 温度由T1升高到T3,NO的转化率增大
难度: 困难查看答案及解析
-
下列由实验得出的结论正确的是
选项
实验
结论
A
将等物质的量的乙烷与氯气混合,光照一段时间
制得纯净的氯乙烷
B
蔗糖在稀硫酸催化作用下水浴加热一段时间
产物只有葡萄糖
C
向苯和液溴的混合物中加入适量铁一段时间后滴入AgNO3溶液,有浅黄色沉淀生成
苯与液溴发生了取代反应
D
将乙烯通入酸性高锰酸钾溶液中,溶液褪色
乙烯具有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。元素W与Z形成的化合物具有还原性,且溶于水后其水溶液显酸性。W所在周期数和族数相同,且W与Y同族、X与Z同族。下列叙述正确的是
A. 最简单气态氢化物的稳定性:X<Z
B. Y与Z的简单离子具有相同的电子层结构
C. X与Y形成的离子化合物中阴阳离子的数目之比为1∶2
D. W与Z形成的化合物的水溶液为强酸
难度: 困难查看答案及解析
-
在含镍酸性废水中用电解法可以实现铁上镀镍并得到氯化钠,其装置如图所示。下列叙述错误的是

A. 待镀铁棒为阴极
B. 选用镍棒替换碳棒,镀镍效果更好
C. 阳极的电极反应式为4OH--4e- ==O2↑+2H2O
D. 通电后中间隔室的NaCl溶液浓度增大
难度: 困难查看答案及解析
-
25 ℃时,将1.0L c mol•L-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是
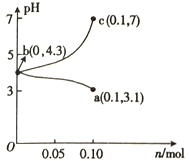
A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,C(CH3COOH)>C(Na+ )>c(OH-)
C. 该温度下,醋酸的电离平衡常数Ka=
D. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
难度: 困难查看答案及解析
-
由下列实验及现象不能推出相应结论的是
选项
实验
现象
结论
A
向Fe(NO3)3溶液中通入SO2,再滴加BaCl2溶液
产生白色沉淀
氧化性:NO3->Fe3+
B
将Na2O2粉末用脱脂棉包裹,向其中吹入CO2
粉末变白,脱脂棉燃烧
Na2O2与CO2反应放热
C.
用铂丝蘸取某待测液在酒精灯上灼烧,透过蓝 色钴玻璃观察
火焰呈紫色
待测液中含钾元素
D
向2支盛有5 mL相同浓度氨水的试管中分别 加入5滴相同浓度的CuCl2溶液和CaCl2溶液
一支试管中产生蓝色沉 淀,另一支无明显现象
Ksp[Cu(OH)2]< Ksp[Ca(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析