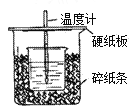
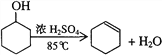
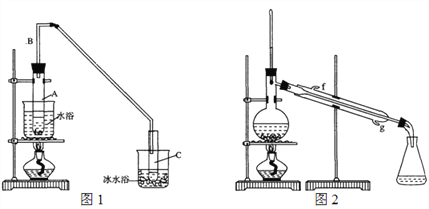
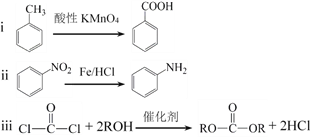
-
有下列几种反应类型:①消去 ②加聚 ③水解 ④加成 ⑤还原 ⑥氧化,用丙醛制取1,2-丙二醇的合成路线中依次发生的反应所属类型为
A. ⑤①④③ B. ⑥④③① C. ①②③⑤ D. ⑤③④①
难度: 中等查看答案及解析
-
《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于
A. 纤维素、油脂 B. 糖类、油脂 C. 纤维素、蛋白质 D. 糖类、蛋白质
难度: 简单查看答案及解析
-
某单烯烃分子中各原子核外电子总数为32,则该烃的所有同分异构体(含顺反异构)共有( )
A. 6种 B. 4种 C. 3种 D. 2种
难度: 中等查看答案及解析
-
下列物质有两种或两种以上的同分异构体,其同分异构体中的某一种烃的一氯取代物只有一种,则这种烃可能是
A. 分子中具有7个碳原子的芳香烃
B. 分子中具有4个碳原子的烷烃
C. 分子中具有5个碳原子的烷烃
D. 相对分子质量为86的烷烃
难度: 中等查看答案及解析
-
下列试剂可以鉴别甲苯、溴乙烷、己烯、乙醇的是
A. 溴水 B. 酸性KMnO4溶液
C. 氢氧化钠溶液 D. 硝酸银溶液
难度: 中等查看答案及解析
-
用甘氨酸和丙氨酸缩合,最多可以形成二肽
A. 1种 B. 2种 C. 3 种 D. 4种
难度: 简单查看答案及解析
-
为探究NaHCO3、Na2CO3与1mol/L盐酸反应过程中的热效应,实验测得如下数据:
序号
试剂/35 mL
固体
混合前温度/℃
混合后温度/℃
①
水
2.5g (0.030mol) NaHCO3
20.0
18.5
②
水
3.2g (0.030mol) Na2CO3
20.0
24.3
③
盐酸
2.5g NaHCO3
20.0
16.2
④
盐酸
3.2g Na2CO3
20.0
25.1
由此得出的结论错误的是
A. Na2CO3溶液与盐酸的反应是放热反应
B. HCO3-(aq)+H+(aq)=CO2(g)+H2O(1) △H>0
C. 含2.5gNaHCO3的饱和溶液(20.0℃)和35mL1mol/L'盐酸(20.0℃)混合后的温度将高于16.2℃
D. 含3.2gNa2CO3的饱和溶液(20.0℃)和35mL1mol/L 盐酸(20.0℃)混合后的温度将高于 25. 1℃
难度: 中等查看答案及解析
-
已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为C(石墨)+O2(g)=CO2 (g) ΔH=-393.51 kJ·mol-1 ,C(金刚石)+O2(g)=CO2 (g) ΔH=-395.41 kJ·mol-1,据此判断,下列说法正确的是( )
①由石墨制备金刚石是吸热反应;②由石墨制备金刚石是放热反应;③等质量时,石墨的能量比金刚石的低;④等质量时,石墨的能量比金刚石的高。⑤石墨比金刚石稳定 ⑥金刚石比石墨稳定
A. ①③⑤ B. ①④⑤ C. ②③⑥ D. ②④⑥
难度: 简单查看答案及解析
-
已知胆矾溶于水时,溶液温度降低。在室温下将1mol无水硫酸铜制成溶液时,放出热量为Q1kJ,而胆矾分解的热化学方程式是CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q2kJ/mol,则Q1与Q2的关系是
A. Q1>Q2 B. Q1<Q2 C. Q1=Q2 D. 无法确定
难度: 简单查看答案及解析
-
下列各组变化中,化学反应的反应热前者大于后者的一组是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1; CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1; H2(g)+½O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2混合后,分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)=Ca(OH)2(s)△H2
A. ①③④ B. ②③ C. ①④ D. ①②④
难度: 简单查看答案及解析
-
已知:N2(g)+3H2(g)
2NH3(g) △H =-92.4 kJ/mol。一定条件下,现有容积相同且恒容的密闭容器甲与乙:① 向甲中通入1 mol N2和3 mol H2,达到平衡时放出热量Q1 kJ;② 向乙中通入0.5 mol N2 和1.5 mol H2,达到平衡时放出热量Q2 kJ。则下列关系式正确的是
A. Q1=2Q2<92.4 B. 92.4=Q1<2Q2
C. Q1=2Q2=92.4 D. 92.4>Ql>2Q2
难度: 中等查看答案及解析
-
已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出X kJ热量。已知单质碳的燃烧热为-Y kJ/mol,则C与1mol O2反应生成CO时的反应热ΔH为
A. -Y kJ/mol B. +(10X-Y) kJ/mol
C. -(5X-0.5Y) kJ/mol D. -(10X-Y) kJ/mol
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知2C(s)+O2(g)=2CO(g) △H=—221 kJ·mol-1, 则可知C的燃烧热为110.5 kJ·mol1
C. 密闭容器中,0.3mol硫粉与0.2mol铁粉混合加热生成硫化亚铁0.2mol时,放出19.12 kJ热量。则Fe(s)+S(s)=FeS(s) △H= - 95.6 kJ·mol1
D. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H= —38.6kJ·mol1
难度: 中等查看答案及解析
-
选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下:
①4NH3(g)+4NO(g)+O2(g)
4N2(g)+6H2O(g) △H1=a kJ·mol-1
②4NH3(g)+2NO2(g)+O2(g)
3N2(g)+6H2O(g) △H2=b kJ·mol-1
副反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H4=d kJ·mol-1
可以计算出反应2NO(g)+O2(g)
2NO2(g)的△H为( )
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d )/4
难度: 中等查看答案及解析
-
N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )

A. N2(g)+3H2(g) = 2NH3(g) ;△H = 2(b—a) kJ/mol
B. N2(g)+3H2(g) = 2NH3(l);△H = 2(a—b—c) kJ/mol
C.
N2(g)+
H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol
D.
N2(g)+
H2(g) =NH3(g) ;△H = (a+b) kJ/mol
难度: 简单查看答案及解析
-
下列各组物质:①C60、C70、金刚石、石墨; ②苯甲醇、对甲基苯酚、邻甲基苯酚、间甲基苯酚;③
C、
C、
C;④HOCH2CHO、HOCH2CH2CHO、HOCH2CH2CH2CHO;⑤新戊烷、2,2-二甲基丙烷; ⑥甲醇、乙二醇、丙三醇。
从左至右按同类有机物、同位素、同系物、同分异构体、同素异形体、同种物质的顺序排列正确的是( )
A. ①⑥②③⑤④ B. ⑥③⑤④①②
C. ④②⑥①⑤③ D. ⑥③④②①⑤
难度: 中等查看答案及解析
-
六苯乙烷为白色固体,其结构如图所示。下列有关说法中正确的是
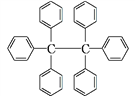
A. 它是一种苯的同系物,易溶于有机溶剂中
B. 它的分子式为C38H30,只含有非极性键
C. 它的一氯代物只有三种
D. 它的分子中所有原子共平面
难度: 中等查看答案及解析
-
下列曲线中各点依次表示乙烷、丙醇、正戊烷、新戊烧的沸点变化,其中合理的是
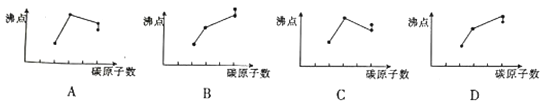
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下述实验方案能达到实验目的的是
编号
A
B
C
D
实
验
方
案




目
的
验证乙炔可与溴发生加成反应
验证淀粉水解产物具有还原性
验证溴乙烷在氢氧
化钠乙醇溶液中发生消去反应产生乙烯
验证碳酸的酸性强于苯酚
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
,如果要合成
,所用的原始原料可以是( )
A. 2 -甲基-l,3 -丁二烯和1 -丁炔 B. l,3 –戊二烯和2 -丁炔
C. 2,3 -二甲基-1,3 -戊二烯和乙炔 D. 2,3 -二甲基-l,3 -丁二烯和丙炔
难度: 困难查看答案及解析
-
我国药学家屠呦呦因发现植物黄花蒿叶中含贫抗疟疾的物质——青蒿素而荣获2015年诺贝尔奖。科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚。
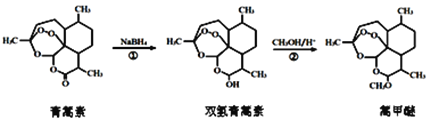
下列说法错误的是
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. ①、②的反应类型分別为还原反应、取代反应
C. 可用质谱法确定分子中含有何种官能团的信息
D. 双氢青蒿素在水中的溶解性大于青蒿素
难度: 简单查看答案及解析
-
下列说法正确的是
A. 按系统命名法
的名称为2—甲基—3,5—二乙基己烷
B. 分子
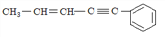 结构中,最多有7个碳原子共线
结构中,最多有7个碳原子共线C. 分子式为C4H10O能与金属钠反应并能发生催化氧化的有机物有4种(不含立体异构)
D. 全降解塑料(
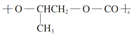 )可由单体环氧丙烷(
)可由单体环氧丙烷()和CO2加聚制得
难度: 中等查看答案及解析
-
有下列高分子化合物:
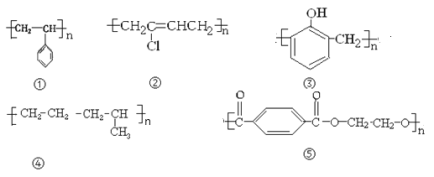
其中由两种不同单体聚合而成的是
A.①⑤ B.③④⑤ C.②④⑤ D.①②④
难度: 中等查看答案及解析
-
黄曲霉素AFTB1,其结构简式如下图所示,它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性。下列说法正确的是
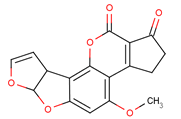
A. 黄曲霉素分子中所有的原子肯定均共面
B. 黄曲霉素分子中含有4个手性碳原子
C. 1mol黄曲霉素最多能与5 mol H2发生加成反应
D. 黄曲霉素可以发生取代、加成、还原反应
难度: 中等查看答案及解析
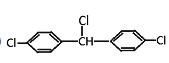 分子中最多有个____原子共面.
分子中最多有个____原子共面.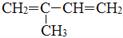 的名称是(用系统命名法命名)_____________,生成顺式聚合物的结构简式是_______________________。
的名称是(用系统命名法命名)_____________,生成顺式聚合物的结构简式是_______________________。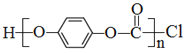 的单体是__________________。
的单体是__________________。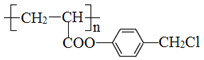 与足量NaOH溶液反应的化学方程式________。
与足量NaOH溶液反应的化学方程式________。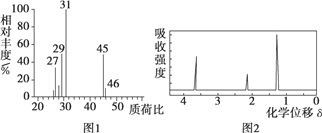
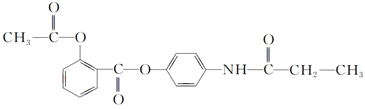
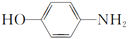 四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。
四种有机物,且相对分子质量大小关系为B>C>D,则B、C、D的结构简式分别是B________;C________;D________。