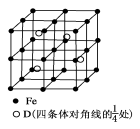
-
化学已经渗透到人类生活的各个方面,下列说法不正确的是
A.2011年3月11日,日本发生大地震,并引发核电厂爆炸,核反应属于物理变化
B.“光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关
C.低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 简单查看答案及解析
-
化学在工业生产和日常生活中都有着重要的应用,下列说法正确的是
A.活性炭、SO2、氯水都会因发生氧化还原反应而使品红溶液褪色
B.Na2O2、H2O2所含化学键完全相同,都能作供氧剂
C.常温下,浓硫酸、浓硝酸与铝均能发生钝化,均能用铝罐储运
D.水玻璃,从分类法的角度,可看作纯净物,可用于木材等的防火剂
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A.CO2的电子式:
B.中子数为20的氯原子:
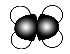
C.乙烯的比例模型:
 D.铝离子结构示意图:
D.铝离子结构示意图:难度: 中等查看答案及解析
-
在分子式为C4H10O的有机物中,含有—OH的同分异构体有(不考虑立体异构)
A.5种 B.4种 C.3种 D.2种
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.向明矾溶液中滴加Ba(OH)2溶液至Al3+ 刚好沉淀完全:2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 3BaSO4↓ + 2Al(OH)3↓
C.NH4HCO3溶于过量的NaOH溶液中:HCO3+OH=CO32+H2O
D.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑
难度: 中等查看答案及解析
-
下列关于有机化合物的结构、性质的叙述正确的是
A.苯、油脂均能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体
D.乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“—OH”
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3-
B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl-
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3-
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42-
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A.6.4 g铜粉与足量硫粉充分反应,失去的电子数为0.2 NA
B. Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4 NA
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
D. 0.5 mol·L-1CuCl2溶液中含有Cu2+数小于0.5 NA
难度: 中等查看答案及解析
-
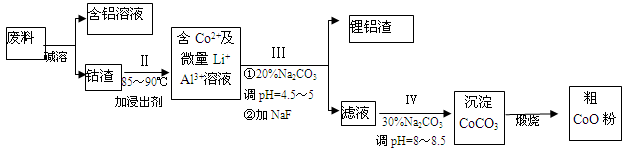
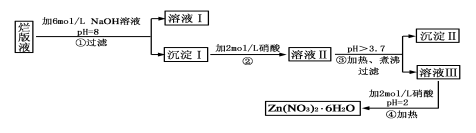
NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是
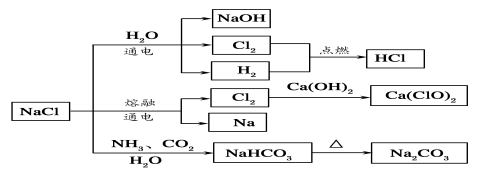
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳和Cl2反应可制得漂白粉,其主要成分是次氯酸钙
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.如图所示转化反应不都是氧化还原反应
难度: 中等查看答案及解析
-
下列说法中正确的是
A.在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率
B.粗铜精炼时,电解液中的c(Cu2+)保持不变
C.Na+的焰色反应呈黄色,属于化学变化
D.在滴定实验中,可以用碱式滴定管量取21.0 mL的NaOH溶液
难度: 简单查看答案及解析
-
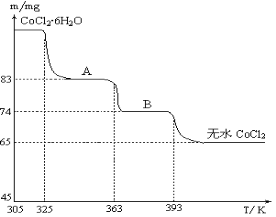
用高铁酸钠(Na2FeO4)对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2 既是氧化剂,又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2参加反应,转移的电子总数为12mol
D.Na2FeO4能消毒杀菌,因其具有强氧化性
难度: 中等查看答案及解析
-
用下图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是

气体
a
b
C
A
浓氨水
生石灰
碱石灰
B
稀硝酸
铜片
碱石灰
C
浓硫酸
浓盐酸
氯化钙
D
SO2
浓硫酸
铜片
硅胶
难度: 中等查看答案及解析
-
可逆反应A(?)+a B(g)
C(g)+2 D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
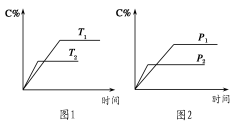
A.当压强由p1变为 p2时,逆反应速率将变大
B.该反应的正反应为放热反应
C.若a=2,则A为液态或固体
D.恒温恒容条件下,增加B的物质的量,B的转化率和该反应的化学平衡常数都将增大
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.加入NaOH溶液,加热后产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42-
D.加盐酸生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
难度: 中等查看答案及解析
-
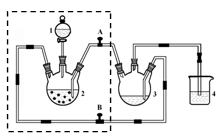
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
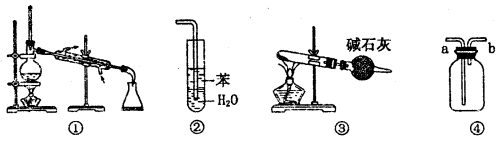
A.装置①常用于分离沸点不同的液体混合物
B.装置②用于吸收氨气,能够防止倒吸
C.以NH4Cl为原料,装置③可制备少量NH3
D.装置④从a口进气可收集Cl2、NO等气体
难度: 中等查看答案及解析
-
下列实验步骤与实验事实的相应结论解释正确的是
选项
实验步骤与实验事实
结论解释
A
Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解
Mg(OH)2Ksp比Al(OH)3的小
B
ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中
CuS的Ksp比ZnS的小
C
在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成
NH3在反应中作催化剂
D
单质硅不溶于浓硫酸和浓硝酸
硅被强氧化性酸钝化
难度: 中等查看答案及解析
-
下列说法正确的是
A. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B. 0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若
LpH=11的NaOH溶液与
LpH=3的HA溶液混合后显中性,则
≤
难度: 中等查看答案及解析
-
将一定量Fe和Fe2O3混合物放入2 mol·L-1的HNO3溶液25mL中,反应完成后,无固体剩余,生成224mLNO气体(标准状况),再向反应后的溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是
A.45mL B.50mL C.40mL D.无法确定
难度: 中等查看答案及解析
-
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是
A.X、Y、Z、W的原子半径依次减小
B.W与X形成的化合物中只含离子键
C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
难度: 中等查看答案及解析
-
将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)
2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
A.该条件下反应的平衡常数为1.6×103
B.通常情况下,该反应一定能自发进行
C.题给条件下,O2的转化率是20%
D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态
难度: 中等查看答案及解析