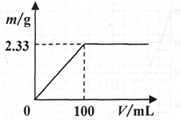
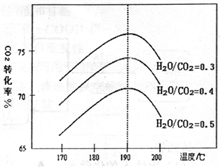
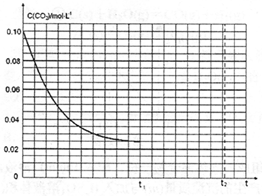
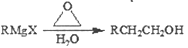-
下列物质中属于碱的是
A. CH4 B. NaOH C. CH3COOH D. KClO
难度: 简单查看答案及解析
-
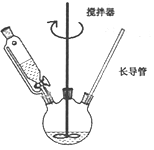
下列仪器名称为蒸馏烧瓶的是
A.
 B.
B. 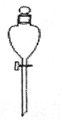 C.
C. 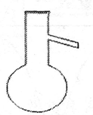 D.
D. 
难度: 简单查看答案及解析
-
下列属于弱电解质的是
A. NH3·H2O B. CuSO4 C. Ba(OH)2 D. 酒精
难度: 中等查看答案及解析
-
下列属于氧化还原反应的是
A. 2Na+2H2O
2NaOH+H2↑+Cl2↑ B. NaOH+HCl═NaCl+H2O
C. CaO+H2O═Ca(OH)2 D. NH4Cl
NH3↑+HCl↑
难度: 简单查看答案及解析
-
下列有关胶体说法正确的是
A. 能用过滤的方法分离出该分散质
B. 在通常情况下不稳定,易沉淀
C. 当聚光手电简照射胶体时,从垂直于光线方向,可以看到一道亮的通路
D. 分散质的直径在10-9〜10-7纳米
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 漂白粉在潮湿空气中易变质
B. 光导纤维的主要成分是硅单质
C. 贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径
D. 钢铁在潮湿空气里比在干燥空气里更易被腐蚀
难度: 中等查看答案及解析
-
下列化学用语表示不正确的是
A. CO2的结构式:O=C=O B. 乙烯的比例模型:
C. 氯离子的结构示意图:
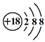 D. KOH的电子式:
D. KOH的电子式:
难度: 简单查看答案及解析
-
下列能使湿润的红色石蕊试纸变蓝的气体是
A. NH3 B. H2S C. SO2 D. CO
难度: 简单查看答案及解析
-
下列反应或操作会明显产生吸热现象的是
A. 将氢氧化钠溶液迅速倒入盛有盐酸的量热计中 B. 浓硫酸加水稀释
C. 氯化铵固体和氢氧化钡固体在烧杯中混合搅拌 D. 甲烷的燃烧
难度: 简单查看答案及解析
-
下列说法正确的是
A. 可以用酒精萃取碘水中的碘单质
B. 配制硫酸铁溶液时向其中加入少量稀硫酸
C. 某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含SO42-
D. 可用pH试纸测定新制氯水的pH
难度: 简单查看答案及解析
-
下列说法正确的是
A. CH3CH2OH是由-C2H5和-OH两种官能团组成的
B. CHFCl2分子结构只有一种
C. H2与D2互为同位素
D. 13C表示核内有6个质子,核外有7个电子的一种核素
难度: 简单查看答案及解析
-
已知 X(g)+3Y(g)
2Z(g) ΔH=-akJ·mol-1(a>0)。一定条件下将1 molX 和3 molY通入2 L的恒容密闭容器中,反应10 min时,测得Y的物质的量为2.4 mol。下列说法正确的是
A. 在10 min内,X和Y反应放出的热量为0.3 a kJ
B. 在l0min时,X和Z的物质的量之比为1:2
C. 达到平衡状态时,X、Y的浓度不再改变
D. 升髙反应温度,逆反应速率增大,正反应速率减小
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 金属钠投入水中:Na+H2O=Na++OH-+H2↑
B. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
C. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
NH3↑+H2O
D. 氯气通入水中:Cl2+H2O
2H++Cl-+ClO-
难度: 简单查看答案及解析
-
X、Y、Z、W均为短周期主族元素,它们在周期表中相对位置如图所示。Z和Y两元素可以形成常见ZY3型化合物,下列说法正确的是
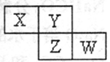
A. X的常见氢化物比Y的常见氢化物稳定
B. X、Z、W的氧化物对应水化物都是常见的强酸
C. W单质不能从盐溶液中置换出Z单质
D. X、Z均可与Y形成原子个数比为1:2的共价化合物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 油脂都能使溴水因发生加成反应而褪色
B. 化合物
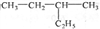 的名称是3-乙基丁烷
的名称是3-乙基丁烷C. 乙炔、丙烯酸(CH2=CHCOOH)、醋酸乙烯酯(CH3COOCH=CH2)均可作为合成聚合物的单体
D. 乙醛和丙烯醛(CH2=CHCHO)不是同系物,它们与氢气充分反应后产物也不是同系物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油
B. 氨基酸为高分子化合物,种类较多,分子中都含有—COOH和—NH2
C. 鸡蛋清中加入浓的食盐水可以杀菌消毒,发生了蛋白质变性
D. 葡萄糖与银氨溶液或含氢氧化钠的氢氧化铜悬浊液的反应可用于检验葡萄糖的存在
难度: 简单查看答案及解析
-
锂锰电池的体积小、性能优良,是常用的一次性电池。该电池反应原理如图所示,其中电解质LiC1O4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。下列说法正确的是
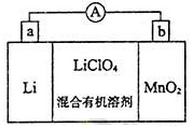
A. 外电路的电流方向是由Li极流向MnO2极
B. 正极的电极反应式:MnO2+Li++e-=LiMnO2
C. Li电极发生还原反应
D. 在放电过程中ClO4-向正极迁移
难度: 中等查看答案及解析
-
下列说法不能证明醋酸(CH3COOH)是弱电解质的是
A. 常温下0.1mol•L-1醋酸溶液稀释1000倍,测得pH约为5
B. 用同浓度的NaOH溶液中和相同体积、相同pH的盐酸和醋酸溶液,比较消耗碱液体积的大小
C. 醋酸钠溶液中加入酚酞试液后变红
D. 0.01mol•L-1的CH3COOH溶液导电性实验中灯泡较暗
难度: 中等查看答案及解析
-
已知:①C(s)+H2O(g)=CO(g)+H2(g) ΔH1=akJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220kJ·mol-1
②断裂1 mol H2(g)中的H—H键需要吸收436 kJ的能量,断裂1mol O2(g)中的共价键需要吸收496kJ的能量,生成H2O(g)中的1 mol H—O键能放出462 kJ的能量。则下列说法正确的是
A. 断裂1 mol H2O(l)中化学键形成H、O原子的过程中需吸收的能量为924 kJ
B. a的值为-130
C. 2H2(g)+O2(g)=2H2O(g) ΔH =-(220+2a)kJ·mol-1
D. 加入某一催化剂能同等程度降低ΔH1、ΔH2的大小
难度: 中等查看答案及解析
-
下列说法正确的是
A. NaHCO3分解过程中,只需克服离子键
B. Na2O溶于水的过程中破坏了离子键和共价键,形成了新的离子键和共价键
C. O3、CO2和SiO2都是由分子构成的
D. 金刚石和足球烯(C60)均为原子晶体,沸点极髙
难度: 简单查看答案及解析
-
臭氧(O3)在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t如下表所示。己知:O3的起始浓度为0.0216 mol·L-1。
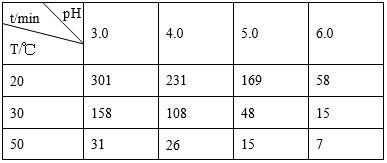
则下列说法不正确的是
A. 30℃、pH=4.0 条件下,O3 的分解速率为 1.00×l0-4mol·L-1·min-1
B. pH增大能加速O3分解
C. 30℃、pH=7.0条件下分解速率小于40℃、pH=3.0
D. 10℃、pH=4.0条件下O3的浓度减少一半所需的时间(t)大于231min
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.2g由氧气和臭氧组成的混合物中含有氧原子的数目为0.3NA
B. 0.1 mol•L-1的FeCl3溶液中Cl-的数目为0.3NA
C. 标准状况下,11.2L苯中含有碳碳双键的数目为1.5NA
D. 1 mol Cl2与足量的铁反应转移的电子数是2 NA
难度: 简单查看答案及解析
-
常温下0.lmol·L-1的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是
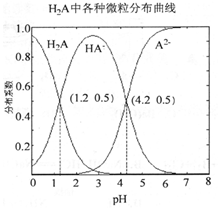
A. H2A为二元弱酸,其电离方程式为:H2A
H++HA-、HA-
H++A2-
B. 在0.lmol•L-1NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 在pH=1.2时,向H2A溶液中加入一定体积的0.lmo l·L-1的NaOH溶液使pH=4.2,则c(A2-)、c(HA-)、c(H2A)之和不变
D. 在 pH=3.0 时:c(A2-)+ c(HA-)<0.lmo l·L-1
难度: 困难查看答案及解析
-
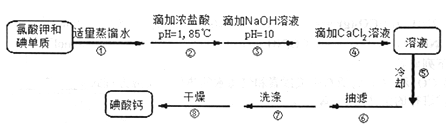
氯化亚铜(CuCl)是白色粉末,微溶于水,能与稀硫酸反应,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究(已知酸性条件下Cu+不稳定)。
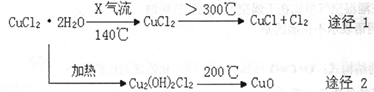
下列说法正确的是
A. X气体可以是N2,目的是做保护气,抑制CuCl2•2H2O加热过程可能的水解
B. CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
C. 途径1中产生的Cl2可以回收循环利用,也可以通入饱和CaCl2溶液中除去
D. 途径2中200℃下反应的化学方程式为:Cu2(OH)2Cl2
2CuO + 2HCl
难度: 中等查看答案及解析
-
某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种(不考虑水中的H+、OH-),且各离子的物质的量浓度相等,为检验上述离子,某兴趣小组设计了如下实验方案:
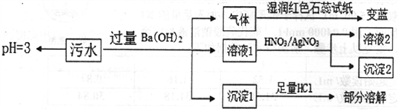
下列说法正确的是
A. 该污水pH=3是由于Fe3+水解引起的 B. 沉淀I为BaCO3和BaSO4
C. 该污水中一定存在Cl-、Fe2+离子 D. 沉淀2可能为AgCl和Ag2SO4
难度: 困难查看答案及解析
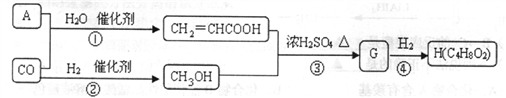


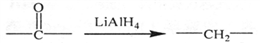
 ②
②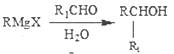 ③
③