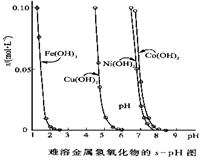
-
设阿伏加德常数为NA,则下列说法正确的是:
A.常温常压下,11.2L甲烷中含有的氢原子数为2NA
B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1 mol•L-1AlCl3溶液中含Al3+ 数为0.1NA
难度: 中等查看答案及解析
-
为确定某溶液的离子组成,进行如下实验:
①测定溶液的pH,溶液显强碱性。
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验以下推测正确的是:
A.一定存在SO32-离子 B.一定存在CO32-离子
C.一定存在Cl-离子 D.可能存在HCO3-离子
难度: 中等查看答案及解析
-
下列说法中,正确的是:
A.胶体区别于其他分散系的本质特征是丁达尔现象
B.利用渗析法可以提纯氢氧化铁胶体
C.非金属氧化物一定是酸性氧化物;碱性氧化物一定是金属氧化物
D.金属阳离子被还原一定得到金属单质
难度: 中等查看答案及解析
-
下列各组离子,一定能大量共存的是:
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:I-、Cl-、HCO3-、Na+
B.含有大量Fe3+的溶液:Na+、HCO3-、NO3-、CO32-
C.加入铝粉能产生氢气的溶液:NH4+、Fe2+、SO42-、Cl-
D.由水电离出的c(H+)=1×10-12 mol•L-1溶液中:K+、Cl-、NO3-、Na+
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为:
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
B.碳酸氢铵溶于过量的烧碱溶液中:HCO3-+OH-=CO32-+H2O
C.少量二氧化硫通入次氯酸钠溶液中:2ClO-+SO2+H2O= 2HClO+SO32-
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价):
A.NaBH4既是氧化剂又是还原剂 B.被氧化的元素与被还原的元素质量比为1:1
C.硼元素被氧化,氢元素被还原 D. NaBH4是氧化剂,H2O是还原剂
难度: 中等查看答案及解析
-
硫—碘循环分解水制氢主要涉及下列反应:
分析上述反应,下列判断正确的是:
A.循环过程中需补充H2O B.反应I中SO2氧化性比HI强
C.反应III易在常温下进行 D.循环过程中产生1molO2的同时产生1 molH2
难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如下图。
反应中镁和铝的:

A.物质的量之比为3:2
B.质量之比为3:2
C.摩尔质量之比为2:3
D.反应速率之比为2:3
难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是:
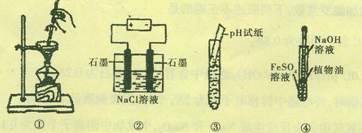
A.图①表示从碘水中分离出碘的操作方法
B.图②为电解氯化钠溶液的装置,一段时间后两极收集到气体的体积之比一定为1:1
C.图③为测定溶液pH的实验操作
D.图④可以用来制备氢氧化亚铁沉淀
难度: 中等查看答案及解析
-
下列说法中,正确的是:
①在水中氢、氧原子间均以化学键相结合。
②金属和非金属化合一定形成离子键。
③离子键的实质是阳离子、阴离子间的相互吸引。
④根据电离方程式HCl = H+ + Cl-,判断HCl分子里存在离子键。
⑤某些共价化合物中含有离子键
A.①②⑤正确 B.都不正确 C. ③④正确 D.仅⑤正确
难度: 中等查看答案及解析
-
下列关于有机物的说法中正确的是:
①棉花、蚕丝和人造丝的主要成分都是纤维素
②淀粉、油脂、蛋白质在一定条件下都能发生水解
③易溶于汽油、酒精、苯等有机溶剂的物质都是有机化合物
④除去乙酸乙酯中残留的乙酸,加过量饱和Na2CO3溶液振荡后,静置分液
⑤塑料、橡胶和纤维都是合成高分子材料
⑥石油的分馏、裂化和煤的干馏都是化学变化
A.①⑤⑥ B.②④ C.①②③⑤ D.②④⑤
难度: 中等查看答案及解析
-
下列说法中,正确的是:
A.熵减的吸热反应可能是自发反应
B.已知C(石墨,s)=C(金刚石,s) △H>0 则金刚石比石墨稳定
C.使用催化剂既不会改变反应的限度又不会改变反应焓变
D.己知2C(s)+2O2(g)=2CO2(g)) △H1 2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
难度: 中等查看答案及解析
-
下列叙述中,不正确的是:
A.工业上电解饱和食盐水的阳极反应:
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:
D.电解池中的阳极和原电池中的负极上都发生还原反应
难度: 中等查看答案及解析
-
在容积相等的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol和b mol HI(a > b),发生反应2HI(g)
H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
A.从开始反应到达平衡,所需时间tA>tB
B.平衡时,I2蒸气在混合气体中的体积分数φA>φB
C.平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B
D.HI的平衡转化率,αA=αB
难度: 中等查看答案及解析
-
对于可逆反应2AB3(g)
A2(g) + 3B2(g) ΔH>0,下列图像正确的是:
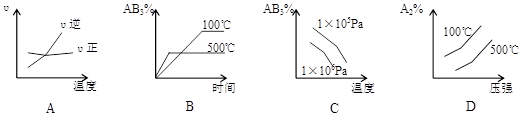
难度: 中等查看答案及解析
-
下列叙述中,正确的是:
A.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶于水后导电情况良好,因此,液氯也是电解质
D.当温度不变时,在纯水中加入强碱不会影响水的离子积常数
难度: 中等查看答案及解析
-
有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;②H2B不是强酸;③HB-的电离程度大于HB-的水解程度;④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-其中错误的是:
A.①② B.③④ C.②③ D.①④
难度: 中等查看答案及解析
-
向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确

A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
难度: 中等查看答案及解析