-
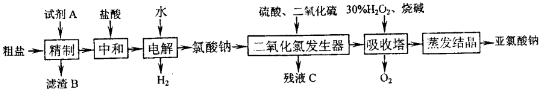
江苏省从今年3月30日起统一公布全省17个监测点PM2.5(大气中直径小于或等于2.5微米的颗粒物)的实时监测数据.下列做法会导致PM2.5污染加重的是( )
A.发展电动汽车,减少燃油汽车的尾气排放
B.开发利用各种新能源,减少对化石燃料的依赖
C.推广煤的气化、液化技术,使用清洁、高效燃料
D.节日期间放烟花爆竹,增加节日气氛难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.HClO分子的结构式:H-O-Cl
B.乙炔分子的电子式:
C.C、α-氨基丙酸分子的结构简式:H2NCH2CH2COOH
D.NaHCO3的电离方程式:NaHCO3═Na++H++CO难度: 中等查看答案及解析
-
下列有关物质的性质或应用的说法中不正确的是( )
A.氢氧化铝可用于治疗胃酸过多
B.工业上通常用电解MgO的方法冶炼金属镁
C.硫和氮的氧化物大量排放可导致酸雨的形成
D.利用丁达尔效应可区别葡萄糖溶液和蛋白质溶液难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1mol•L-1KI溶液中:Cu2+、Fe3+、NO、Cl-
B.pH=1的溶液中:K+、Mg2+、SO、NO
C.c(H)=1.0×10-13mol•L-1溶液中:C6H5O-、Na+、SO、Br-
D.c=1mol•L-1的溶液中:NH、Al3+、SO
、Cl-
难度: 中等查看答案及解析
-
设nA表示阿伏伽德罗常数的值.下列叙述正确的是( )
A.42g C3H6中含有的共用电子对数目为8nA
B.1mol Na2O2与足量的CO2充分反应,转移的电子数目为nA
C.常温常压下,22.5L N2和O2的混合气体中含有的分子数目为nA
D.1L 0.01mol•L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02nA难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.用二氧化锰与浓盐酸反应制取氯气:MnO2+4H++4Cl-Mn2++2Cl2↑+2H2O
B.实验室用铜和稀硝酸反应制取少量一氧化氮气体:Cu+4H++NOCu2++NO↑+2H2O
C.硫酸氢钠溶液与氢氧化钡溶液反应至中性:2H++SO+Ba2++2OH-═BaSO4↓+2H2O
D.碳酸钠溶液与过量的水杨酸()混合:
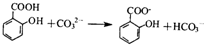
难度: 中等查看答案及解析
-
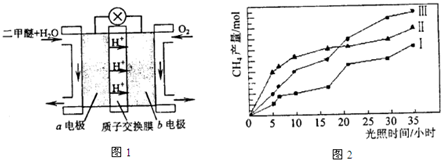
下列说法正确的是( )
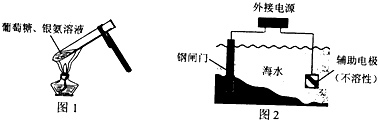
A.实验室利用图1操作进行银镜反应,试管内壁可以生成光亮银镜
B.图2所示钢闸门的防腐办法中,钢闸门应与外接电源的正极相连
C.用NaOH溶液除去乙酸乙酯中的乙酸
D.鸡蛋清溶液中加入浓硝酸有白色沉淀,加热,沉淀变黄色难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子半径及主要化合价如下表:
下列叙述正确的是( )元素 X Y Z W 原子半径/10-12m 102 110 75 99 主要化合价 -2、+4、+6 +5、+3、-3 +5、+3、-3 -1、+5、+7
A.气态氰化物的热稳定性:Y>Z
B.W元素形成的含氧酸都是强酸
C.化合物X2W2中既含有离子键又含有共价键
D.W的单质与X的氢化物反应,可生成X的单质难度: 中等查看答案及解析
-
NH3是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )
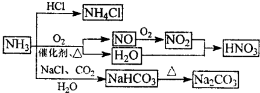
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均可以发生水解反应难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
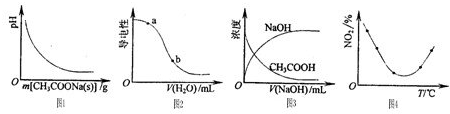
A.图1表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化
B.图2表示在CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图3表示将NaOH稀溶液滴加到CH3COOH稀溶液中,NaOH、CH3COOH浓度随NaOH溶液体积的变化曲线
D.图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)⇌N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0难度: 中等查看答案及解析
-
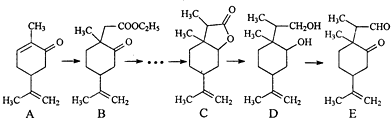
甲、乙、丙三种物质是某抗生素合成过程中的中间产物
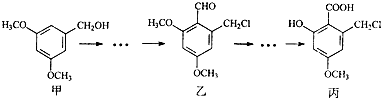
下列说法正确的是( )
A.甲、乙、丙三种有机化合物均可跟NaOH溶液反应
B.甲、乙、丙三种有机化合物均可发生消去反应
C.可用FeCl3溶液区别甲、丙两种有机化合物
D.丙水解的有机产物在一定条件下可以发生缩聚反应难度: 中等查看答案及解析
-
下列有关实验原理、方法和结论都正确的是( )
A.将SO2通入溴水中,溴水褪色,说明SO2具有漂白性
B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡
C.将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,可检验CH3CH2Br是否发生水解
D.向含有FeBr2的溶液中,加入适量氯水,再加入CCl4萃取、分液,可得到FeCl2溶液难度: 中等查看答案及解析
-
下列说法正确的是( )
A.反应4Fe(OH)2(s)+O2(g)+2H2O(l)═4Fe(OH)3(s)的△H>0
B.电解精炼铜时,用粗铜作阳极、纯铜作阴极、CuSO4溶液作电解质溶液
C.25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大
D.pH=5的CH3COOH溶液和pH=5的AlCl3溶液中,水的电离程度相同难度: 中等查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.0.1mol•L-1的(CH3COO)2Ba溶液中:c(Ba2+)+c(H+)═2c(CH3COO-)+c(OH-)
B.常温下,向醋酸钠溶液中滴加稀盐酸至中性的混合液中:c(Cl-)>c(Na+)>c(CH3COOH)
C.常温下,pH=6的NaHSO3溶液中:c(SO)-(H2SO3)=9.9×10-6mol•L-1
D.0.1mol•L-1的KOH溶液与0.1mol•L-1的H2C2O4溶液以任何体积比混合所得溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O)=0.1mol•L-1
难度: 中等查看答案及解析
-
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.1mol H2O(g),发生反应:2H2O(g)
2H2(g)+O2(g),△H=+484kJ•mol-1,不同时间产生O2的物质的量见下表:
下列说法正确的是( )时间/min 20 40 60 80 n(O2)/moL 0.0010 0.0016 0.0020 0.0020
A.前20min的反应速率v(H2O)=2.5×10-5mol•L-1•min-1
B.达平衡时,至少需要从外界吸收的能量为0.968kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关难度: 中等查看答案及解析