-
(原创) 化学与社会、生产、生活紧切相关,下列说法正确的是
A.为了治理酸雨污染,政府应取缔硫酸厂、火电厂、水泥厂等
B.我国是稀土储量大国,可以大量开采稀土矿卖给全世界,赚取外汇
C.减少燃煤的使用,改用风能、太阳能等能源,符合“低碳生活”理念
D.由铝土矿(主要含Al2O3,还含有Fe2O3、SiO2等杂质)冶炼金属铝的过程中,只涉及复分解反应
难度: 中等查看答案及解析
-
已知X(g)+3Y(g)═ 2Z(g)△H>0,下列对该反应的说法中正确的是
A.△S>0
B.逆向能自发进行,且反应速率和平衡常数均较大
C.反应物总能量大于生成物总能量
D.在任何温度下都不能自发进行
难度: 中等查看答案及解析
-
(原创) 下列化学用语使用正确的是
A. N2的结构式:N = N
B. H2O的比例模型:
C. HClO的电子式:
D. MgBr2的形成过程用电子式表示为:
难度: 中等查看答案及解析
-
(原创) 参考消息网6月14日报道:美媒称,中国即将批量生产更为优秀的航空发动机。新发动机将适应更高的内部温度,拥有更出色的性能或耐用性,很可能被安装在作战飞机上,这表明中国工程师已掌握了制造镍基含铼单晶合金叶片的技术(因熵增原理,致成品易含杂质,不易制备)。查资料发现:铼(Re)的熔点3180℃,沸点5627℃;纯铼质软,有良好的机械性能;自然界有2种铼原子
、
,下列说法中正确的是
A.镍基含铼单晶合金属于金属晶体
B.
和
互称为核素
C.铼(Re)元素的相对原子质量为186
D.含铼合金比纯铼的熔点高、硬度大
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,不能达到实验目的的是
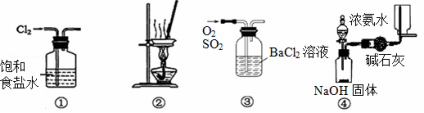
A.用装置①除去Cl2中含有的少量HCl
B.用装置②从KCl溶液中获得KCl晶体
C.用装置③除去O2中混有的一定量SO2
D.用装置④在实验室制取并收集氨气
难度: 中等查看答案及解析
-
(原创)能用键能大小解释的是
A.稀有气体一般很难发生化学反应
B.常温常压下,氟气的密度小于氯气
C.相同条件下,NH3在水中的溶解度大于PH3
D. SiC晶体的熔点比晶体硅的高
难度: 中等查看答案及解析
-
下列排列顺序正确的是
A.熔点:MgBr2> Cs > Na
B.微粒半径:Ca2+ > C1- > Mg2+
C.碱性:KOH > Mg(OH)2 > Al(OH)3
D.氧化性:Cu2+ > Fe3+ > K+
难度: 中等查看答案及解析
-
(原创)短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34g/mol,Y的最低价氢化物为非电解质。则下列说法中正确的是
X
Y
Z
W
Q
A.阴离子还原性:W > Q
B.X的最低价氢化物能形成分子间氢键
C.Q单质能溶于水,且水溶液须用棕色细口瓶盛装
D.Na与Y能形成化合物Na2Y2,且与水反应后溶液呈碱性
难度: 中等查看答案及解析
-
(原创)用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,46g NO2中含有的分子数为NA
B.通常状况下,14g CO含有的电子数目为7NA
C.1L 0.2 mol/L的CH3COOH溶液中,H+ 数目为0.2NA
D.0.1mol Cu 和与40mL 10mol/L硝酸反应后,溶液中的NO3-数目为0.2NA
难度: 中等查看答案及解析
-
(原创)下列离子方程式错误的是
A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
B.向KI溶液中加H2SO4溶液后振摇:4H+ + 4I-+ O2 = 2I2 + 2H2O
C.酸性高锰酸钾中加入草酸,溶液褪色:2MnO4- + 5H2C2O4 + 6 H+ = 2Mn2+ + 10CO2↑ +8H2O
D.证明C的非金属性强于Si的反应:SiO32- + CO2+ H2O = H2SiO3↓+ CO32-
难度: 中等查看答案及解析
-
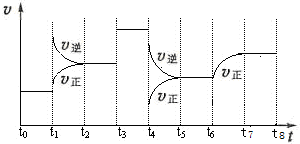
(原创)下图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况。达到平衡后,改变压强,平衡不移动。下列说法中正确的是
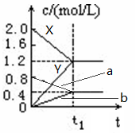
A. Z物质的变化情况为曲线b
B. 该反应的化学方程式为:2X(g)
3Y(g) + Z(g)
C. 0→t1,X的物质的量浓度变化量为1.2mol/L
D. 若t1= 1min,则v(Y )= 0.02 mol·L-1·s-1
难度: 中等查看答案及解析
-
(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
A.H2O2的分解反应为放热反应
B.FeCl3是H2O2分解反应的催化剂
C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多
D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同
难度: 中等查看答案及解析
-
(原创)已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
A.对比等浓度的两种酸的pH
B.对比等浓度的两种酸,与相同大小镁条反应的初始速率
C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量
D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积
难度: 中等查看答案及解析
-
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+ 2Pb2+(aq)+ H2O(l)
2PbCrO4(s)+ 2H+(aq)△H<0
该反应达平衡后,改变条件,下列说法正确的是
A.移走部分PbCrO4固体,Cr2O72-转化率升高
B.升高温度,该反应的平衡常数(K)增大
C.加入少量NaOH固体,自然沉降后,溶液颜色变浅
D.加入少量K2Cr2O7固体后,溶液中c(H+)不变
难度: 中等查看答案及解析
-
(原创)科学家发现海洋是一个名副其实的“聚宝盆”,一些国家觊觎我国南海海域的丰富资源,导致近年来南海争端不断。下列对海洋资源开发利用的说法不正确的是
A. 海底如“土豆”般的金属结核矿含有铁、锰、钴等多种元素,可用铝热法冶炼并分离得到各种金属单质
B.海水淡化工厂可与化工生产结合,如淡化后的浓海水,可用于提溴、镁、钠等
C.海水中的金、铀等元素储量高、浓度低,提炼时,须先富集
D.海水提镁过程中,所需的石灰乳,可用贝壳煅烧后加水得到,体现了就地取材、降低成本的生产理念
难度: 中等查看答案及解析
-
已知有反应:I2(g)+H2(g)
2HI(g)△H<0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中x的值,则y随x变化趋势合理的是
选项
X
Y

A
温度
容器内混合气体的密度
B
I2的物质的量
H2的转化率
C
H2的浓度
平衡常数K
D
加入Ar的物质的量
逆反应速率
难度: 中等查看答案及解析
-
(原创)向100mL 0.1mol/L醋酸溶液中加入下列物质,混合溶液有关量或性质变化趋势正确的是
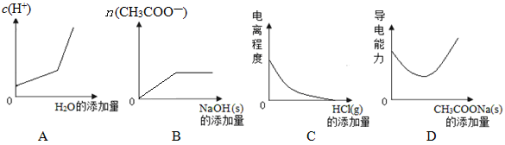
难度: 中等查看答案及解析
-
已知2SO2 (g)+O2 (g)
2SO3 (g);△H =﹣197kJ•mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
SO2 (mol)
O2 (mol)
SO3 (mol)
甲
2
1
0
乙
4
2
0
丙
0
0
2
恒温、恒容下反应达平衡时,下列关系一定正确的是
A.SO3的质量m:2m甲 = m乙
B.容器内压强P:2P丙 > P乙
C.反应放出或吸收热量的数值Q:Q甲 > Q丙
D.c(SO2)与c(O2)之比a:a丙 > a乙
难度: 中等查看答案及解析