-
第三届联合国环境大会的主题为“迈向无污染的地球”。下列做法不应提倡的是
A. 推广电动汽车,践行绿色交通
B. 改变生活方式,预防废物生成
C. 回收电子垃圾,集中填埋处理
D. 弘扬生态文化,建设绿水青山
难度: 简单查看答案及解析
-
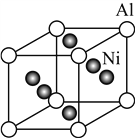
冰晶石可由Al(OH)3、NaCl、CaF2及H2SO4等原料生产。有关化学用语表示错误的是( )
A. 冰晶石的化学式: Na3AlF5 B. 中子数为13的铝原子:
Al
C. 氯离子的结构示意图:
D. CaF2的电子式:
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. MnO2不溶于水,可用作H2O2分解的催化剂
B. SO2具有漂白性,可用于制溴工业中吸收Br2
C. FeCl3溶液显酸性,可用于蚀刻铜制的电路板
D. NH4NO3分解产生大量气体,可用作汽车安全气囊产气药
难度: 中等查看答案及解析
-
一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2
CCl4
正十二烷
密度/g·cm-3
3.119
1.595
0.753
沸点/℃
58.76
76.8
215~217
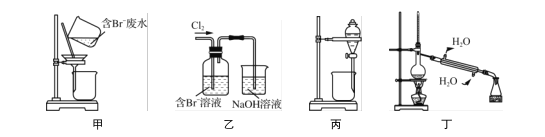
下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X、W同主族,Y的原子半径是所有短周期主族元素中最大的,Z是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法正确的是
A. 原子半径:r(X)<r(Z)<r(W)
B. 简单氢化物的热稳定性:X<W
C. Y、Z、W的最高价氧化物的水化物两两之间均能反应
D. X 分别与Y、W形成的化合物中所含化学键类型相同
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. NO2通入水中: 3NO2+H2O=2H++2NO2 -+NO
B. Fe(OH)3溶于HI 溶液: Fe(OH)3+3H+=Fe3++3H2O
C. (NH4)2SO4溶液中加入Ba(OH)2 溶液: NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
D. 向NaAlO2溶液中滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O=Al(OH)3 ↓+CO
难度: 困难查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. MnO2
Cl2
SiCl4 B. Fe
 Fe2O3
Fe2O3FeCl3
C. S
SO2
BaSO3 D. CuSO4
Cu(OH)2
Cu
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明溶液中: Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞变红的溶液中: K+、Na+、CO
、AlO
C. c(ClO-)=1mol·L-1的溶液中: Fe2+、Al3+、NO
、I-
D.
=0.1 mol·L-1的溶液中: NH
、Mg2+、SO
、CH3COO-
难度: 中等查看答案及解析
-
已知:4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑ ,测得c(FeO42-)在不同条件下变化如图甲、乙、丙、丁所示:
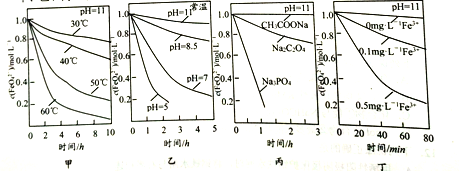
下列说法正确的是
A. 图甲表明,其他条件相同时,温度越低FeO42-转化速率越快
B. 图乙表明,其他条件相同时,碱性越强FeO42-转化速率越快
C. 图丙表明,其他条件相同时,钠盐都是FeO42-优良的稳定剂
D. 图丁表明,其他条件相同时,碱性条件下Fe3+能加快FeO42-的转化
难度: 困难查看答案及解析
-
一种生物电化学方法脱除水体中NH4+的原理如下图所示:
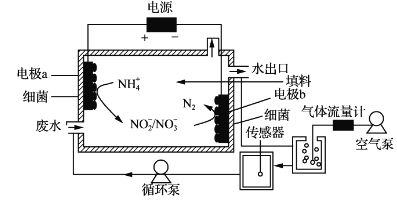
下列说法正确的是
A. 装置工作时,化学能转变为电能
B. 装置工作时,a极周围溶液pH降低
C. 装置内工作温度越高。NH4+脱除率一定越大
D. 电极b上发生的反应之一是:2NO3--2e-=N2↑+3O2↑
难度: 困难查看答案及解析
-
黄檀内酯是一种具有抗肿瘤、抗菌、抗氧化等生物活性的天然化合物,可由香兰素为原料合成(如下图所示)。
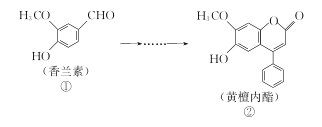
下列说法正确的是( )
A. ①、②分子中碳原子一定都处于同一平面
B. ①、②均能使酸性KMnO4溶液褪色
C. 化合物①能与NaHCO3反应产生CO2
D. 1 mol化合物②最多只能与2molNaOH反应
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向酸性含碘废水中加入淀粉溶液,然后滴入少量Na2SO3溶液,废水立刻变蓝色
该废水中可能含IO3-
B
向Fe(NO3) 3 溶液中加入铁粉,充分报荡,再滴加少量盐酸酸化后,滴入1滴KSCN溶液,溶液变红
原Fe(NO3)3 只有部分被Fe还原
C
向1-溴丙烷中加入KOH溶液,加热并充分振荡,然后取少量液体滴入AgNO3溶液,出现棕黑色沉淀
1-溴丙烷中混有杂质
D
将乙醇与浓硫酸混合溶液加热,产生的气体直接通入酸性KMnO4溶液,溶液紫色逐渐褪去
产生的气体一定是乙烯
A. A B. B C. C D. D
难度: 困难查看答案及解析
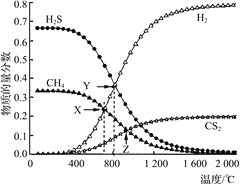
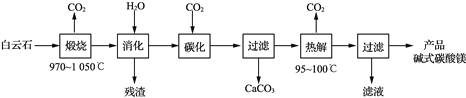
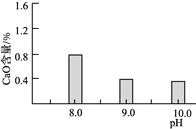
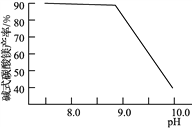
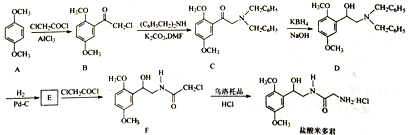
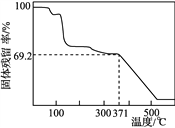
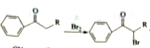 ,请写出以
,请写出以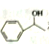 和
和 为原料制备
为原料制备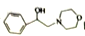 的合成路线流程图______(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图______(无机试剂任用,合成路线流程图示例见本题题干)。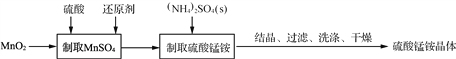
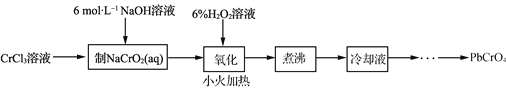
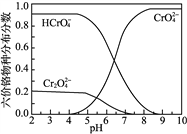

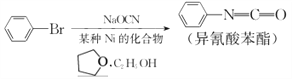 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。