-
短周期元素A、B、C、D、E的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和C同主族,D原子最外层电子数与电子层数相等,在中学常见的酸中E的最高价氧化物对应的水化物的酸性最强。下列叙述正确的是( )
A. 氧元素与A、B、C形成的二元化合物均只有两种
B. 简单离子半径:E>C>D>B
C. 由A、B、E三种元素只能形成含有共价键的共价化合物
D. C、D、E三种元素的最高价氧化物对应的水化物两两之间均能发生反应
难度: 中等查看答案及解析
-
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确的是
A. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL
B. 当金属全部溶解时收集到NO气体的体积一定为2.24 L
C. 参加反应的金属的总质量3.6 g<m<9.6 g
D. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol
难度: 困难查看答案及解析
-
下列离子方程式书写正确且能合理解释事实的是
A. 将铜丝插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
B. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O
C. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时问后,溶液变蓝:4H+ +4I- +O2=2I2 +2H2O
D. 向含0.1 mol FeBr2的溶液中通入0.1 mol Cl2:2Fe2++4Br-+3C12=2Fe3++2Br2+6C1-
难度: 困难查看答案及解析
-
下列有关化学与生产、生活的说法中,不正确的是
A. 陶瓷、水泥和玻璃都属于硅酸盐产品
B. “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同
C. 铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
D. 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
难度: 中等查看答案及解析
-
分类思想是研究化学的常用方法,下列分类叙述正确的是( )
A. 既有单质参加又有单质生成的反应一定是氧化还原反应
B. 淀粉、纤维素、油脂均属于天然高分子
C. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
难度: 困难查看答案及解析
-
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol·L-1羟胺的酸性溶液与足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50 mL 0.020 mol·L-1酸性KMnO4溶液完全反应。已知:FeSO4+KMnO4+H2SO4―→Fe2(SO4)3+K2SO4+MnSO4+H2O(未配平),则羟胺的氧化产物是 ( )
A. N2 B. N2O
C. NO D. NO2
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
操作
现象
结论
A
向某溶液中加入NaOH 溶液,并将红色石蕊试纸置于溶液中
试纸变蓝
原溶液中有NH4+
B
向苏打和小苏打溶液中分别加入盐酸
均冒气泡
两者均能与盐酸反应
C
向某溶液中滴加氯水后,再加KSCN溶液
溶液变红
该溶液中一定有Fe3+
D
向某无色溶液中滴加BaCl2溶液
产生白色沉淀
该无色溶液中一定含有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液.下列判断不正确的是
A. 化合物KCrO2中Cr元素为+3价
B. 实验①证明Cr2O3是两性氧化物
C. 实验②证明氧化性:Cr2O72﹣>I2
D. 实验③证明H2O2既有氧化性又有还原性
难度: 中等查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A. 9.0L B. 13.5L C. 15.7L D. 16.8L
难度: 中等查看答案及解析
-
下列有关氧化还原反应的叙述正确的是( )
A. 化合反应和复分解反应不可能是氧化还原反应
B. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
C. 含有最高价元素的化合物不一定具有很强的氧化性
D. 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原
难度: 中等查看答案及解析
-
下列表达方式正确的是
A.
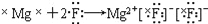 B. 质子数为17、中子数为20的氯原子:2017Cl
B. 质子数为17、中子数为20的氯原子:2017ClC. HClO的结构式:H—O—Cl D. NH4Cl的电子式:
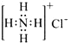
难度: 简单查看答案及解析
-
朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里…… 月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾所形成的种种美景的最本质原因是
A. 空气中的小水滴颗粒大小约为10-9 m~10-7 m B. 光是一种胶体
C. 雾是一种胶体 D. 发生丁达尔效应
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列有关说法不正确的是
A. 由1mol CH3OCOONa和少量CH3COOH形成的中性溶液中,CH3COO-数目是NA
B. 1.68gFe与足量高温水蒸气反应,转移电子的数目为0.09NA
C. 氢原子数为0.4NA的CH3OH 分子中含有的电子数为1.8NA
D. 常温下,2L 0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液所含Fe3+数目不同
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: Zn2+、SO42-、NH4+,Cl-
B. 0.1mol/L NaHCO3溶液中: Mg2+、Al3+、K+、NO3-
C. 能使甲基橙变黄的溶液中: Na+,CH3COO-、 MnO4-、 Fe3+
D. c(H+)/c(OH-)=1×1012的溶液中:NO3-、I-、K+、Fe2+
难度: 中等查看答案及解析
-
常温下,下列四种酸溶液,能跟铝片反应放出H2且反应速率最快的是
A. 20mL 18.4mol·L−1的硫酸溶液 B. 10mL 3mol·L−1的硫酸溶液
C. 20mL 5mol·L−1的盐酸溶液 D. 30mL 4mol·L−1的硝酸溶液
难度: 简单查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是
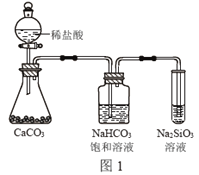
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 图1所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“
”(ào)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析
-
将50g溶质质量分数为w1,物质的量浓度为c1 的较浓氨水沿玻璃棒加入到u mL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀氨水。若c1 =2c2,则:
A. w1>2w2,u>50 B. w1<2w2,u<50 C. w1=2w2,u<50 D. w1﹥2w2,u﹤50
难度: 困难查看答案及解析
-
下列叙述正确的是
A. 将SO2通入Ba(NO3)2溶液中,产生沉淀,此沉淀是BaSO3
B. 在稀硫酸中加入铜粉,铜粉不溶解;再加入KNO3固体,铜粉仍不溶解
C. 向AlCl3溶液中滴加氨水,产生白色沉淀,再加入过量NaHSO4溶液,沉淀溶解
D. 在Fe(OH)3 胶体中加入稀盐酸,可观察到红褐色胶体变为棕黄色溶液
难度: 困难查看答案及解析
-
某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2 的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
难度: 困难查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
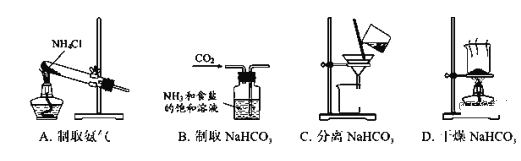
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列有关热化学方程式及其叙述正确的是
A. 氢气的燃烧热为-285.5 kJ/mol,则水电解的热化学方程式为:2H2O(l) =2H2(g)+O2(g) △H=+285.5 kJ/mol
B. lmol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为:1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(l) △H=-445 kJ/mol
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1,则C(s)的燃烧热为-110. 5kJ/mol
D. HF与NaOH 溶液反应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ/mol
难度: 中等查看答案及解析
-
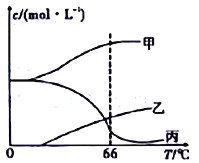
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述不正确的是
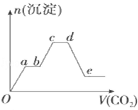
A. Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O
B. ab段与cd段所发生的反应相同
C. de段沉淀减少是由于BaCO3固体消失
D. bc段反应的离子方程式是2AlO2﹣+3H2O+CO2═2Al(OH)3↓+CO32﹣
难度: 困难查看答案及解析
-
海水提镁的主要流程如下,下列说法正确的是
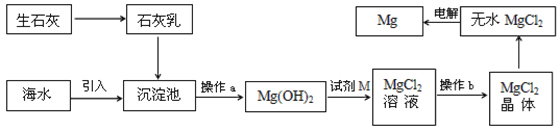
①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
难度: 中等查看答案及解析
-
H2在Cl2中燃烧时产生苍白色火焰.在反应过程中,断裂1molH2中的化学键消耗的能量为Q1KJ,断裂1molCl2中的化学键消耗的能量为Q2KJ,形成1molHCl中的化学键释放的能量为Q3KJ.下列关系式正确的是 ( )
A. Q1+Q2>Q3 B. Q1+Q2>2Q3 C. Q1+Q2<Q3 D. Q1+Q2<2Q3
难度: 中等查看答案及解析
-
铁、铜混合粉末17.6 g加入到800mL 1.0mol/L的 FeCl3溶液中,充分反应后,所得溶液中Fe2+和Cu2+物质的量浓度之比为8∶1。下列有关说法正确的是
A. 混合粉末中铁与铜的物质的量之比是1∶2
B. 反应后的溶液最多还可以溶解铁粉5.6g
C. 反应后所得溶液中c(Fe2+)=1.0mol/L (假设反应前后溶液体积无变化)
D. 向反应后的溶液中加入2.0 mol/L NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是1.6 L
难度: 困难查看答案及解析
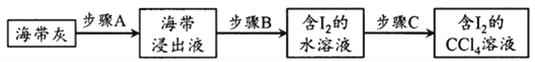
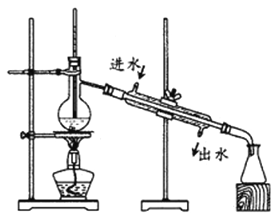
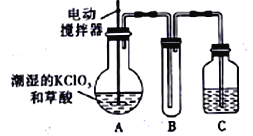
 5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。
5KCl+KC1O3+3H2O 制取KC1O3,再用稍潮湿的KC1O3和草酸(H2C2O4) 在60℃时反应制取ClO2气体,装置如图所示。ClO2是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。