-
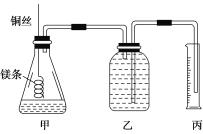
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
难度: 简单查看答案及解析
-
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A. p(Ne)>p(H2)>p(O2) B. p(O2)>p(Ne)>p(H2)
C. p(H2)>p(O2)>p(Ne) D. p(H2)>p(Ne)>p(O2)
难度: 中等查看答案及解析
-
在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是( )
A. SO42- B. NH4+
C. Al3+ D. Ca2+
难度: 中等查看答案及解析
-
检验Na2CO3溶液中是否混有Na2SO4,应使用的试剂是( )
A. BaCl2溶液和稀硫酸 B. BaCl2溶液
C. Ba(NO3)2溶液 D. BaCl2溶液和稀盐酸
难度: 简单查看答案及解析
-
要除去NaCl溶液中混有的MgCl2应选用的试剂和操作方法是( )
A. 加入适量Na2SO4溶液后过滤 B. 加入适量NaOH溶液后过滤
C. 加入过量NaOH溶液后蒸发 D. 加入过量Na2CO3溶液后过滤
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 铜丝能导电,所以铜是电解质
B. 固体氯化钠不导电,所以氯化钠不是电解质
C. SO3溶于水能导电,所以SO3是电解质
D. 氯化氢水溶液能导电,所以氯化氢是电解质
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol H2含有的分子数目为2NA
B. 0.5 mol H2SO4所含的原子总数目为0.5NA
C. 1 mol O3含有的氧原子数为2NA
D. 0.5 mol H2O含有NA个氢原子和0.5NA个氧原子
难度: 简单查看答案及解析
-
下列反应中必须加入还原剂才能进行的是
A. Cl2→Cl- B. Zn→ Zn2+
C. H2→H2O D. CuO→CuCl2
难度: 简单查看答案及解析
-
将20 mL0.5 mol•L﹣1K2SO3溶液逐滴加入到20 mL 0.2 mol•L﹣1硫酸酸化的紫色KMnO4溶液中,溶液恰好变为无色,则Mn元素在产物中的存在形态是( )
A. Mn B. Mn2+ C. Mn2O3 D. K2MnO4
难度: 中等查看答案及解析
-
室温下,在强碱性溶液中不能大量共存的离子组是( )
A. Ba2+、Na+、
、Cl- B. K+、Na+、
、S2-
C. K+、Na+、
、
D.
、Cu2+、Cl-、
难度: 简单查看答案及解析
-
下列状态的物质,既属于电解质又能导电的是( )
A. 氯化镁晶体 B. 氯化钠溶液
C. 液态氯化氢 D. 熔融氢氧化钾
难度: 简单查看答案及解析
-
下列有关胶体的说法不正确的是( )
A. 分散系中分散质粒子的大小:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B. FeCl3溶液和Fe(OH)3胶体都能透过滤纸
C. 当一束强可见光通过Fe(OH)3胶体时会出现光亮的“通路”
D. 将饱和FeCl3溶液滴入NaOH溶液中可制得Fe(OH)3胶体
难度: 简单查看答案及解析
-
某溶液溶质的质量分数为10%,下面说法正确的是( )
①在100份质量溶液中含有10份质量溶质;②在110份质量溶液中含有10份质量溶质;
③在100份质量溶剂中含有10份质量溶质;④在90份质量溶剂中溶有10份质量溶质。
A. ①② B. ③④ C. ②③ D. ①④
难度: 简单查看答案及解析
-
在如图所示的装置中,U型管内盛有氢氧化铁胶体,两个管口各插入一个碳棒作为电极。通电一段时间后,下列叙述正确的是( )
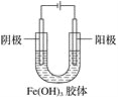
A. Fe(OH)3胶体粒子带正电荷,阴极附近的颜色变浅
B. Fe(OH)3胶体粒子带负电荷,阳极附近的颜色变浅
C. Fe(OH)3胶体粒子向阴极移动,阴极附近的颜色变深
D. Fe(OH)3胶体粒子向阳极移动,阳极附近的颜色变深
难度: 简单查看答案及解析
-
氢氧化铁胶体稳定存在的主要原因是
A. 胶粒直径小于1 nm B. 胶粒不停地作无规则运动
C. 胶粒带正电荷 D. 胶粒不能通过半透膜
难度: 简单查看答案及解析
-
下列说法正确的是
A. 氧化还原反应的本质是元素化合价的升降
B. 氧化还原反应一定有氧元素参加
C. 氧化反应一定先于还原反应
D. 发生氧化反应的物质也可能同时发生还原反应
难度: 简单查看答案及解析
-
如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )
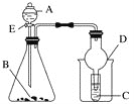
A. 若A为醋酸,B为贝壳(粉状),C为澄清石灰水溶液,则C中溶液变浑浊
B. 若A为浓盐酸,B为锌粒,C中盛滴有酚酞的NaOH溶液,则C中溶液褪色
C. 若A为双氧水,B为MnO2,C中为NaOH溶液,D为防倒吸装置
D. 实验中仪器D可起到防倒吸的作用
难度: 中等查看答案及解析
-
KMnO4+HCl(浓)―→KCl+MnCl2+H2O+Cl2,方程式配平后,HCl前的化学计量数为( )
A. 8 B. 12 C. 16 D. 20
难度: 中等查看答案及解析
-
下列有关气体体积的描述中,正确的是( )
A. 一定温度和压强下,气体的体积主要由分子间的距离决定
B. 通常状况下,气体摩尔体积约为22.4 L
C. 标准状况下,气体摩尔体积约为22.4 L
D. 单位物质的量的气体所占的体积就是气体摩尔体积
难度: 简单查看答案及解析
-
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M。其物质的量浓度之比为c(NO3-)∶c(SO42-)∶c(Fe3+)∶c(H+)∶c(M)=2∶3∶1∶3∶1,则M可能是:
A.Al3+ B.Cl- C.Mg2+ D.Ba2+
难度: 简单查看答案及解析
-
把5%的碳酸钠溶液蒸发掉64.3 g水后,溶液变为31 mL,浓度变为14%,没有晶体析出,则浓缩后碳酸钠溶液的物质的量浓度为( )
A. 8.52 mol·L-1 B. 4.26 mol·L-1
C. 1.52 mol·L-1 D. 3.04 mol·L-1
难度: 中等查看答案及解析
-
某铁的氧化物(FexO)3.48 g溶于足量盐酸中,向所得溶液中通入0.532 5 g Cl2,恰好将Fe2+完全氧化,则x值为( )
A. 0.67 B. 0.75 C. 0.80 D. 1.00
难度: 中等查看答案及解析
-
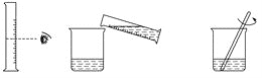
若在试管中加入2~3 mL液体再加热,正确的操作顺序是( )
①点燃酒精灯进行加热
②在试管中加入2~3 mL液体
③用试管夹夹持在试管的中上部
④将试剂瓶的瓶盖盖好,放在原处
A. ②③④① B. ②④③①
C. ③②④① D. ③②①④
难度: 简单查看答案及解析
-
下列溶液中,溶质的物质的量浓度为1mol/L的是( )
A. 含Na+为2mol的Na2SO4溶液
B. 将80g SO3溶于水并配成1L的溶液
C. 将0.5mol/L的某饱和溶液100mL,加热蒸发掉50g水后的溶液
D. 将58.5gNaCl溶于1L水所得的溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列对0.3 mol·L-1硫酸钾溶液的说法中正确的是( )
A. 1 L溶液中含0.3NA个K+
B. 1 L溶液中含0.9NA个离子
C. 2 L溶液中K+浓度是1.2 mol·L-1
D. 2 L溶液中含0.6NA个离子
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是 ( )
A. 在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B. 在含大量Ba2+的溶液中:NH4+、Na+、Cl﹣、OH﹣
C. 在强碱溶液中:Na+、K+、Cl﹣、SO32-
D. 在强酸溶液中:K+、Fe2+、Cl﹣、CH3COO﹣
难度: 中等查看答案及解析
-
现有三组溶液:①煤油和氯化钾溶液、②35%的乙醇溶液、③碘单质和氯化钠固体,分离以上各混合体系最合适的方法依次是( )
A. 分液、蒸馏、萃取 B. 萃取、蒸馏、升华
C. 分液、蒸馏、升华 D. 蒸馏、分液、萃取
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 阴离子只有还原性
B. 含有最高价元素的化合物,只有氧化性,不具有还原性
C. Zn和稀硫酸反应既属于离子反应,也属于氧化还原反应
D. 没有单质参加也没有单质生成的反应一定不是氧化还原反应
难度: 中等查看答案及解析
-
下列物质中属于电解质的是( )
A. 二氧化碳 B. 食盐水 C. 蔗糖 D. 烧碱
难度: 简单查看答案及解析
-
ag 硝酸钾溶于bg水,形成VmL饱和溶液。下列关系式错误的是( )
A. 该溶液的物质的量浓度:c(KNO3)=
mol·L-1
B. 该溶液的质量分数:w(KNO3)=
%
C. 20 ℃时KNO3的溶解度S=
g
D. 该溶液的密度ρ=
g·L-1
难度: 中等查看答案及解析