-
下列各组关于强电解质、弱电解质、非电解质的归类正确的( )
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
BaSO4
H2CO3
Fe(OH)3
非电解质
蔗糖
CCl4
酒精
H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知两个热化学方程式: C(s)+O2(g) =CO2(g) ΔH=―393.5kJ/mol
2H2(g)+O2(g) =2H2O(g) ΔH=―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A. 1︰1 B. 1︰2 C. 2︰3 D. 3︰2
难度: 困难查看答案及解析
-
2g碳与水蒸气反应生成CO和H2,需吸收21.88kJ热量,此反应的热化学方程式为
A. C + H2O ==CO + H2ΔH =+131.3kJ·mol—1
B. C(s)+ H2O(g) ==CO(g) + H2(g)ΔH =+10.94kJ·mol—1
C. C(s)+ H2O(g) ==CO(g) + H2(g)ΔH = -131.3kJ·mol—1
D. C(s)+ H2O(g) ==CO(g) + H2(g)ΔH = +131.3kJ·mol—1
难度: 简单查看答案及解析
-
反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E1、E2、E3、E4表示活化能)。下列说法正确的是

A. 两步反应的ΔH均大于0 B. 加入催化剂能改变反应的焓变
C. 三种物质中C最稳定 D. A→C反应的ΔH=E4-E1
难度: 困难查看答案及解析
-
在2A(g) + B(g)⇌3C(g) + 4D(g)中,表示该反应速率最快的是
A. v(A)=0.05 mol/(L·S)
B. v(B)=0.3 mol/(L·min)
C. v(C)=1.2 mol/(L·min)
D. v(D)=0.6 mol/(L·min)
难度: 中等查看答案及解析
-
对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5⇌NO3+NO2快速平衡
第二步 NO2+NO3→NO+NO2+O2慢反应
第三步 NO+NO3→2NO2快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是
A. v(第一步的逆反应) < v(第二步反应)
B. 反应的中间产物只有NO3
C. 第二步中NO2与NO3的碰撞仅部分有效
D. 第三步反应活化能较高
难度: 中等查看答案及解析
-
对于100 mL 1 mol/L盐酸与铁片的反应,采取下列措施:①升高温度②改用300 mL 0.1 mol/L盐酸;③改用50 mL 3 mol/L盐酸;④用等量铁粉代替铁片;⑤加入少量CH3COONa固体。其中能使反应速率减慢的是
A. ③⑤ B. ①③ C. ②③ D. ②⑤
难度: 中等查看答案及解析
-
某温度下,对可逆反应2X(g) + Y(g) ⇌3Z(g) + W(g) ΔH>0 的叙述正确的是
A. 升高温度,混合气体的平均摩尔质量减小
B. 将W液化移走,则正反应速率增大,平衡向右移动
C. 温度、体积不变,充入He气增大压强,反应速率会加快
D. 增大压强,正反应速率增大,逆反应速率减小
难度: 中等查看答案及解析
-
下列叙述及解释正确的是
A. 2NO2(g)(红棕色)⇌N2O4(g)(无色)△H<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g) + I2(g)⇌2HI(g) △H<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. 对于N2+3H2⇌2NH3,平衡后,压强不变,充入Ar,平衡左移
D. FeCl3+3KSCN⇌Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
难度: 中等查看答案及解析
-
已知反应①:CO(g)+CuO(s) ⇌CO2(g)+Cu(s)反应②:H2(g)+CuO(s) ⇌Cu(s)+H2O(g),二者在温度T下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是
A. 反应①的平衡常数K1=c(CO2).c(Cu)/[c(CO).c(CuO)]
B. 反应③的平衡常数K=K1•K2。
C. 对于反应③,恒容时,温度升高,K值减小,则正反应△H<0
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
难度: 中等查看答案及解析
-
将固体NH4HS置于密闭容器中,在某温度下发生下列反应:NH4HS(s)⇌NH3(g)+H2S(g), H2S(g)⇌H2(g)+S(g)。当反应达到平衡时C(H2)=0.5 mol/L,C(H2S)=4.0 mol/L,则第一步的平衡常数为
A. 16 (mol/L)2 B. 18 (mol/L)2
C. 20.25 (mol/L)2 D. 22 (mol/L)2
难度: 中等查看答案及解析
-
对于反应:4CO(g)+2NO2(g)
4CO2(g)+N2(g) △ H=-1200 kJ·mol-1,温度不同 (T2>T1),其他条件相同时,下列图像正确的是( )
A.
 B.
B. 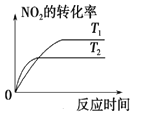 C.
C. 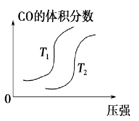 D.
D. 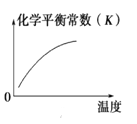
难度: 中等查看答案及解析
-
在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是
A. 正反应为吸热反应 L是气体
B. 正反应为放热反应 L是气体
C. 正反应为吸热反应 L是固体
D. 正反应为放热反应 L是固体或液体
难度: 困难查看答案及解析
-
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g) △H=+74.9kJ·mol﹣1,下列说法中正确的是
A. 该反应是吸热反应,因此一定不能自发进行
B. 该反应熵增,所以一定可以自发进行
C. 该反应中ΔS>0、所以高温可以自发进行
D. 自发进行的反应可能是放热反应,不能自发进行的反应都是吸热反应
难度: 中等查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对3A2(g)+B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的
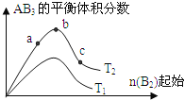
A. a、b、c三点平衡常数的大小关系为:Kb>Kc >Ka
B. 达到平衡时B2的转化率大小为:b>a>c
C. 增大压强有利于AB3的生成,因此在实际生产中压强越大越好
D. 若起始量为
,则在T2温度下,平衡时AB3的体积分数接近b点
难度: 中等查看答案及解析
-
在一定条件下CO(g)和H2(g)发生反应:CO(g) +2H2(g) ⇌CH3OH(g)。在容积固定且均为1 L的a、b、c三个密闭容器中分别充入1 mol CO (g)和2 mol H2 (g),三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到5 min时CH3OH (g)的浓度如下图所示。下列说法正确的
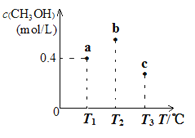
A. 该反应的正反应△H >0
B. 当三个容器内的反应都达到化学平衡时,CO转化率最大的是α(a)
C. 三个容器中平衡常数最大的是c容器中的平衡常数
D. 反应均进行到5min时,b点一定达到平衡状态
难度: 中等查看答案及解析
-
醋酸的电离方程式为CH3COOH(aq)⇌H+(aq)+CH3COO-(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液Ka=1.75×10-5 。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
难度: 中等查看答案及解析
-
某浓度的氨水中存在下列平衡:NH3·H2O⇌ NH4+ +OH -,如想增大NH4+的浓度,而不增大OH -的浓度,应采取的措施是
A. 加入NH4Cl固体 B. 适当升高温度
C. 通入NH3 D. 加入少量NaOH
难度: 中等查看答案及解析
-
已知电离平衡常数H2SO3:H2SO3⇌HSO3- + H+ K1=1.54×10-2 ,HSO3⇌SO32- + H+ K2=1.02×10-7; H2CO3:H2CO3⇌HCO3- + H+ K1=4.4×10-7HCO3-⇌CO32- + H+ K2=4.7×10-11,则溶液中不可以大量共存的离子组是
A. HSO3-、CO32- B. HSO3-、HCO3-
C. SO32-、HCO3- D. SO32-、CO32-
难度: 中等查看答案及解析
-
在两个容积均为1 L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g) + 6H2(g)
C2H4(g) + 4H2O(g) ΔH。CO2的平衡转化率
α(CO2)与温度的关系如下图所示。

下列说法正确的是
A. 该反应的ΔH > 0
B. 氢碳比:X< 2.0
C. 在氢碳比为2.0时,Q点v(逆)小于P点的v(逆)
D. P点温度下,反应的平衡常数为512
难度: 困难查看答案及解析