-
Ⅰ.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)⇌2ClNO(g) 平衡常数为K1;
②2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) 平衡常数为K2。
(1)4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
(2)若反应①在温度T下达到平衡时,平衡常数为K1,升高温度后K1增大,则正反应的焓变△H____0(填“>”、“<”或“=”)。若平衡后在其他条件不变的情况下,充入少量Cl2,Cl2的转化率___________(填“变大”、“变小”或“不变”,下同), 的值___________。
的值___________。
Ⅱ.近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。
CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。
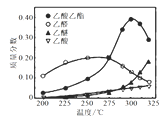
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
-
Ⅰ研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g) 2ClNO(g) ∆H1 <0 其平衡常数为K1
2ClNO(g) ∆H1 <0 其平衡常数为K1
b、2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
NaNO3(s)+ClNO(g)∆H2 < 0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ∆H3 的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ∆H3 的平衡常数K= (用K1、K2表示)。∆H3= (用∆H1、∆H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内V(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:

其总反应式为H2+2NiOOH 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时(放电),甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时(放电),甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g) 2ClNO(g) ΔH1<0,平衡常数为K1;
2ClNO(g) ΔH1<0,平衡常数为K1;
②2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
NaNO3(s)+ClNO(g) ΔH2<0,平衡常数为K2。
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K=___________________(用K1、K2表示)。ΔH3=___________(用ΔH1、ΔH2表示)。
(2)为研究不同条件对反应①的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应①达到平衡。测得10 min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=__________mol,NO的转化率α1=___________。其他条件保持不变,反应①在恒压条件下进行,平衡时NO的转化率为α2,α1____α2(填“>”“<”或“=”),平衡常数K1______________(填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是___________。
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
① 2NO(g)+Cl2(g) 2ClNO(g) ΔH1<0 平衡常数为K1;
2ClNO(g) ΔH1<0 平衡常数为K1;
② 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
NaNO3(s)+ClNO(g) ΔH2<0 平衡常数为K2;
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:_________________。ΔH3=__________(用ΔH1、ΔH2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH3,平衡常数K的表达式为:_________________。ΔH3=__________(用ΔH1、ΔH2表示)。
(2)①为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应①达到平衡。测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)=______mol,NO的转化率α1=______。
②其他条件保持不变,反应②升高温度,平衡时NO2的转化率_____((填“增大”“减小”或“不变”),平衡常数K2______(填“增大”“减小”或“不变”)。
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如表所示反应:
①2NO(g)+Cl2(g)⇌2ClNO(g)△H1<0,平衡常数为 K1;
②2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)△H2<0,平衡常数为 K2。
(1)4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)△H3,平衡常数 K=______(用 K1、K2 表示)。△H3=_________(用△H1、△H2 表示)。
(2)①为研究不同条件对反应①的影响,在恒温条件下,向 2 L 恒容密闭容器中加入0.2 mol NO 和 0.1 mol Cl2,10 min 时反应①达到平衡。测得 10 min 内 v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后 n(Cl2)=__________mol,NO 的转化率α1=__________。
②其他条件保持不变,反应①在恒压条件下进行,平衡时 NO 的转化率为α2,α1 ________α2(填“>”“<”或“=”),平衡常数 K1 ________ (填“增大”“减小”或“不变”)。若要使 K1 减小,可采用的措施是 ________。
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g) + NaCl(s) NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
NaNO3(s) + ClNO(g) K1 ∆H < 0 (I)
2NO(g) + Cl2(g) 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g) + 2NaCl(s)  2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
2NaNO3(s) +2NO(g) + Cl2(g) 的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”、“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2 + 2NaOH == NaNO3 + NaNO2 + H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol·L‾1的CH3COONa溶液,则两溶液中c(NO3—)、c(NO2—)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10—4mol·L‾1,CH3COOH的电离常数K a=1.7×10—5mol·L‾1),可使溶液A和溶液B的pH相等的方法是 (选填序号)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
-
(12分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H1 < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H1 < 0 (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H2 < 0 (II)
2ClNO(g) K2 ∆H2 < 0 (II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内 (ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
-
(12分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1 <0(I)
NaNO3(s)+ClNO(g) K1 ΔH1 <0(I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2 <0(II)
2ClNO(g) K2 ΔH2 <0(II)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
(用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应(II)达到平衡。
测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
-
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ),
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=_____________mol,NO的转化率α1=______________。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2 ,其反应为:2CO+2NO N2+2CO2 ΔH<0
N2+2CO2 ΔH<0
①在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是(________)
A.反应混合物各组分物质的量浓度相等
B.NO、CO、CO2、N2分子数之比为2:2:2:1
C.混合气体的密度保持不变
D.单位时间内消耗1mol NO的同时,就有1molCO生成
②达到平衡后下列能提高NO转化率的是(________)
A.选用更有效的催化剂 B.保持容器体积不变充入氦气增大压强
C.降低反应体系的温度 D.缩小容器的体积
③研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | a | b | c | 124 |
| Ⅲ | 350 | d | e | 124 |
表中:a=_______________,e=__________________
-
(10分)研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=_____________mol,NO的转化率α1=_____________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2_____________α1(填“>”“<”或“=”),平衡常数K2___________(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是____________。
的值___________。
CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。

