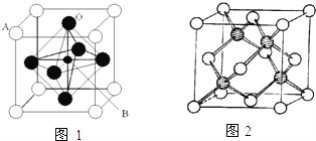
-
下列各物质中,按熔点由高到低的顺序排列正确的是( )
A. CH4>SiH4>GeH4>SnH4
B. KCl>NaCl>MgCl2>MgO
C. Rb>K>Na>Li
D. 石墨>金刚石>SiO2
难度: 中等查看答案及解析
-
X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子总数的3倍。下列有关叙述正确的是( )
A. Y原子的价层电子排布式为3s23p5 B. 稳定性:Y的氢化物>Z的氢化物
C. 第一电离能:Y<Z D. X、Y两元素形成的化合物为离子化合物
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 分子晶体中的每个分子内一定含有共价键
B. 原子晶体中的相邻原子间只存在非极性共价键
C. 离子晶体中可能含有共价键
D. 金属晶体的熔点和沸点都很高
难度: 中等查看答案及解析
-
下列既有离子键又有共价键的化合物是( )
A. Na2O B. NaOH C. CaBr2 D. HF
难度: 中等查看答案及解析
-
下列对[Zn(NH3)4]SO4配合物的说法不正确的是( )
A. SO42﹣是内界 B. 配位数是4
C. Zn2+是中心离子 D. NH3是配位体
难度: 简单查看答案及解析
-
已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中的位置正确的是( )
A. 第三周期ⅣA族,p区
B. 第四周期ⅡB族,s区
C. 第四周期Ⅷ族,d区
D. 第四周期ⅡA族,s区
难度: 中等查看答案及解析
-
下列关于能层与能级的说法中正确的是
A. 原子核外每一个能层最多可容纳的电子数为n2
B. 任一能层的能级总是从s能级开始,而且能级数等于该能层数
C. 不同能层中s电子的原子轨道半径相同
D. 不同能层中p电子的原子轨道能量相同
难度: 中等查看答案及解析
-
石墨是层状晶体,每一层内,碳原子排列成正六边形,许多个正六边形排列成平面网状结构。如果每两个相邻碳原子间可以形成一个碳碳单键,则石墨晶体中每一层碳原子数与碳碳单键数的比是
A. 1∶1 B. 1∶2 C. 1∶3 D. 2∶3
难度: 中等查看答案及解析
-
在下列化学反应中,所断裂的共价键中,仅仅断裂δ键的是 ( )
A. N2+3H2
 2NH3
2NH3B. 2C2H2+5O2
 2H2O+4CO2
2H2O+4CO2C. Cl2+H2
 2HCl
2HClD. C2H4+H2
C2H6
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. CH4,C2H2,HCN都是含有极性键的非极性分子
B. CO2与SO2的立体构型相似,都是非极性分子
C.
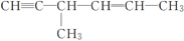 分子中含有1个手性碳原子
分子中含有1个手性碳原子D. 无机含氧酸分子中有几个氢原子,它就属于几元酸
难度: 中等查看答案及解析
-
不能用金属键理论解释的是
A. 导电性 B. 导热性 C. 延展性 D. 锈蚀性
难度: 简单查看答案及解析
-
下列各组微粒,不能互称为等电子体的是
A. NO2、NO2+、NO2﹣ B. CO2、N2O、N3﹣
C. CO32﹣、NO3﹣、SO3 D. N2、CO、CN﹣
难度: 中等查看答案及解析
-
下列各组微粒中不属于等电子体的是( )
A. CH4、NH4+ B. H2S、HCl C. CO2、N2O D. CO32-、NO3-
难度: 中等查看答案及解析
-
R元素的原子,其最外层的p能级电子数等于所有的能层s能级电子总数,则R可能是
A. Li B. Be C. S D. Ar
难度: 中等查看答案及解析
-
物质的下列性质或数据与氢键无关的是
A. 甲酸蒸气的密度在373 K时为1.335 g/L,在297 K时为2.5 g/L
B. 邻羟基苯甲酸(
 )的熔点为159℃,对羟基苯甲酸(
)的熔点为159℃,对羟基苯甲酸( )的熔点为213℃
)的熔点为213℃C. 乙醚微溶于水,而乙醇可与水以任意比混溶
D. HF分解时吸收的热量比HCl分解时吸收的热量多
难度: 中等查看答案及解析
-
1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠时释放出的热能为氯化钠的晶格能。下列热化学方程式中,反应热的绝对值等于氯化钠晶格能的数值的是
A. Na+(g)+Cl-(g)===NaCl(s);ΔH1=a kJ·mol-1
B. Na+(g)+1/2Cl2(g)===NaCl(s);ΔH2=b kJ·mol-1
C. NaCl(s)===Na(g)+Cl(g);ΔH3=c kJ·mol-1
D. Na(g)+Cl(g)===NaCl(s);ΔH4=d kJ·mol-1
难度: 中等查看答案及解析
-
根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是
A. 乙烯 B. 二氧化碳 C. 二氧化硫 D. 氢气
难度: 中等查看答案及解析
-
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是( )
A. C3N4晶体是分子晶体
B. C3N4晶体中C—N键的键长比金刚石中C—C键的键长要长
C. C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D. C3N4晶体中微粒间通过离子键结合
难度: 中等查看答案及解析
-
若某元素原子处于能量最低状态时,外围电子排布式为4d15s2,则下列说法正确的是
A. 该元素原子处于能量最低状态时,原子中共有3个未成对电子
B. 该元素原子核外共有5个电子层
C. 该元素原子的M层共有8个电子
D. 该元素原子最外层有3个电子
难度: 中等查看答案及解析
-
以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.:He B.
C.1s2 D.
难度: 中等查看答案及解析
-
钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是( )
A. 上述钛原子中,中子数不可能为22
B. 钛元素在周期表中处于第四周期ⅡB族
C. 钛原子的外围电子排布为3d24s2
D. 钛元素位于元素周期表的d区,是过渡元素
难度: 简单查看答案及解析
-
某元素基态原子的最外层电子排布式为ns2,该元素( )
A. 一定是第ⅡA族元素
B. 一定是金属元素
C. 不是第ⅡA族元素就是副族元素
D. 可能是金属元素也可能是非金属元素
难度: 中等查看答案及解析
-
钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是( )
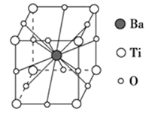
A. BaTi8O12 B. BaTi4O6 C. BaTi2O4 D. BaTiO3
难度: 中等查看答案及解析
-
下列分子的中心原子的杂化轨道类型相同的是 ( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H4与C2H2
难度: 中等查看答案及解析
-
有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. 用电子式表示AD2的形成过程为
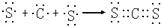
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
难度: 困难查看答案及解析