-
已知反应2C(s)+O2(g) ===2CO(g)的ΔH<0,ΔS>0。设ΔH和ΔS不随温度而变,下列说法中正确的是( )
A. 低温下才能自发进行
B. 高温下才能自发进行
C. 任何温度下都能自发进行
D. 任何温度下都不能自发进行
难度: 简单查看答案及解析
-
下列说法能够用勒·夏特列原理来解释的是( )
A. 加入催化剂可以提高单位时间氨的产量
B. 高压有利于氨的合成反应
C. 700 K高温比室温更有利于合成氨的反应
D. 恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 25 ℃时,在pH=4的盐酸和NH4Cl溶液中,由水电离出的H+浓度相等
B. 25 ℃时,pH=3和pH=5的盐酸等体积混合后,溶液的pH=4
C. 25 ℃时,pH=9和pH=11的NaOH溶液等体积混合后,溶液的pH=10
D. 25 ℃时,pH=3.6的某橙汁中的c(H+)是pH=5.6的某西瓜汁中的c(H+)的100倍
难度: 中等查看答案及解析
-
常温下,能证明乙酸是弱酸的实验事实是
A. 0.1mol/L CH3COONa溶液的pH大于7
B. CH3COOH溶液的导电能力弱
C. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
D. CH3COOH溶液与Na2CO3反应生成CO2
难度: 简单查看答案及解析
-
一定温度下,在一固定体积的密闭容器中,对于可逆反应:A(s)+3B(g)
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为1∶3∶2;⑥C的体积分数不再变化
A. ②④⑤ B. ①③④⑥
C. ①②④⑥ D. ①②③④⑤
难度: 中等查看答案及解析
-
工业上利用可逆反应N2(g)+3H2(g)
2NH3(g)合成氨,下列叙述正确的是
A. 合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率
B. 恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=(c2-c1)/(t2-t1)
难度: 中等查看答案及解析
-
某温度下,反应H2(g)+I2(g)
2HI(g) ΔH<0,在一带有活塞的密闭容器中达到平衡,下列说法不正确的是 ( )
A. 恒温,压缩体积,平衡不移动,颜色加深
B. 恒压,迅速充入HI,开始时正反应速率减小
C. 恒容,升温逆反应速率增大,正反应速率减小
D. 恒容,充入H2,I2转化率增大
难度: 简单查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):根据以上规律判断,下列结论正确的是( )

A. 反应Ⅰ:ΔH>0,p2>p1
B. 反应Ⅱ:ΔH<0, T2>T1
C. 反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1
D. 反应Ⅳ:ΔH<0,T2>T1
难度: 困难查看答案及解析
-
在一定的温度下,将2mol A和3mol B充入一密闭容器中发生如下反应:aA(g)+B(g)
C(g)+D(g),5 min后达到平衡。已知该温度下反应的平衡常数K=1,在t0时刻,若保持温度不变将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
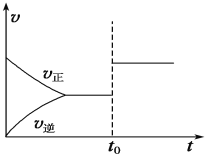
A. 正反应是一个体积减小的反应,a=2
B. 速率随时间的变化关系可用上图表示
C. 达平衡时B的转化率为40%
D. 为提高A的转化率,可采取升高温度的措施
难度: 中等查看答案及解析
-
向绝热恒容的密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g)
SO3(g)+NO(g),其正反应速率(v正)随时间(t)变化的关系如图所示。下列结论中错误的是( )

A. 反应在c点达到平衡状态
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. 逆反应速率:c点大于b点
难度: 中等查看答案及解析
-
CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③增大装置的压强 ④装置中放入碱石灰
A. ①③④ B. ①②③ C. ②③④ D. ①②③④
难度: 简单查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是( )
A. 将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B. 向纯水中加入少量NaOH溶液,平衡逆向移动, KW变小
C. 向纯水中加入少量盐酸,平衡逆向移动,c(H+)增大,KW不变
D. 向纯水中加入醋酸钠,平衡正向移动,KW增大
难度: 简单查看答案及解析
-
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法正确的是( )

A. 两溶液稀释前的浓度相同
B. a、b、c三点溶液的pH由大到小顺序为a>b>c
C. a点的Kw值比b点的Kw值大
D. a点水电离的n(H+)大于c点水电离的n(H+)
难度: 中等查看答案及解析
-
下列离子方程式表示的是盐类的水解且正确的是( )
A. HS-+H2O
H3O++S2-
B. HS-+H+===H2S
C. CO32-+2H2O
H2CO3+2OH-
D. Fe3++3H2O
Fe(OH)3+3H+
难度: 简单查看答案及解析
-
化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32-水解
C. 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理
D. 配制FeCl3溶液时加入少量的盐酸,抑制Fe3+水解
难度: 简单查看答案及解析
-
298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述不正确的是( )
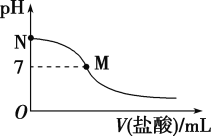
A. 该滴定过程应选择甲基橙作为指示剂
B. M点对应的盐酸体积小于20.0 mL
C. M点: c(NH4+)+ c(NH3·H2O) =c(Cl-)
D. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
常温下,下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D.
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
难度: 中等查看答案及解析
-
25 ℃时,Ksp(BaSO4)=1×10-10 mol2·L-2,Ksp(BaCO3)=5.1×10-9 mol2·L-2。在该温度下,下列说法不正确的是( )
A. 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaSO4比BaCO3溶解度更小
B. 若误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,会引起Ba2+中毒
C. 向同浓度Na2SO4和Na2CO3的混合液中滴加BaCl2溶液,BaSO4先析出
D. 在BaSO4的饱和溶液液中,c(SO42-)=1.0×10-5mol·L-1
难度: 简单查看答案及解析