-
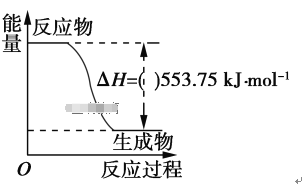
25℃和1.01×105Pa,反应2N2O5(g) = 4NO2(g) + O2(g);△H=" +" 56.76 kJ·mol-1能自发进行反应的原因是
A. 是吸热反应
B. 是放热反应
C. 是熵减少的反应
D. 熵增大效应大于能量效应
难度: 简单查看答案及解析
-
在下列各说法中,正确的是
A. ΔH>0表示放热反应,ΔH<0表示吸热反应
B. 热化学方程式中的化学计量数只表示物质的量,可以是分数
C. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
难度: 中等查看答案及解析
-
常温下下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B. 由水电离出的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、Cl-、HCO3-、K-
C. c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
难度: 简单查看答案及解析
-
下列反应的能量变化与其它三个不相同的是
A. 铝粉与氧化铁的反应
B. 氯化铵与消石灰的反应
C. 锌片与稀硫酸反应
D. 钠与冷水反应
难度: 简单查看答案及解析
-
雪是冬之精灵,在雪
水
冰的转化中能量变化的叙述正确的是
A. ΔH1>0,ΔH2>0 B. ΔH1>0,ΔH2<0
C. ΔH1<0,ΔH2<0 D. ΔH1<0,ΔH2>0
难度: 中等查看答案及解析
-
准确量取25.00毫升高锰酸钾溶液,可选用的仪器是
A. 50 mL量筒 B. 10 mL量筒 C. 50 mL酸式滴定管 D. 50 mL碱式滴定管
难度: 中等查看答案及解析
-
已知2SO2+O2
2SO3(g),若反应速率分别用v(SO2)、v(O2)、v(SO3)表示,则下列式子正确的是
A. 2v(SO3)=v(O2) B. v(SO2)=v(O2)=v(SO3)
C. 1/2v(SO2)=v(O2) D. v(O2)=2v(SO2)
难度: 中等查看答案及解析
-
利用反应2NO(g)+2CO(g)
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1 ,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 增大压强同时加催化剂
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
难度: 简单查看答案及解析
-
已知气体A和气体B反应生成液态C为放热反应,则下列热化学方程式书写正确的是(a>0)
A. A(g)+2B(g)===C(l) ΔH=+a kJ/mol B. A+2B===C ΔH=-a kJ/mol
C. A(g)+2B(g)===C(l) ΔH=-a kJ D. A(g)+2B(g)===C(l) ΔH=-a kJ/mol
难度: 中等查看答案及解析
-
已知在25℃、101 kPa条件下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834.9 kJ·mol-1
4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1
由此得出的结论正确的是
A. 等质量的O2比O3能量低,由O2变O3为放热反应
B. 等质量的O2比O3能量高,由O2变O3为吸热反应
C. O3比O2稳定,由O2变O3为放热反应
D. O2比O3稳定,由O2变O3为吸热反应
难度: 简单查看答案及解析
-
某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是
A. OA段表示开始时,反应速率较快
B. AB段表示反应速率较快,可能因为产物有催化作用
C. BC段表示反应速率最快,在该时间内收集到的气体最多
D. OC线表示随时间增加,反应速率逐渐增大
难度: 中等查看答案及解析
-
反应2SO2(g)+O2(g)
2SO3(g) ΔH<0已达平衡,其他条件不变时,分别改变下列条件,对化学反应速率和化学平衡会产生影响,下列条件与图像不相符的是
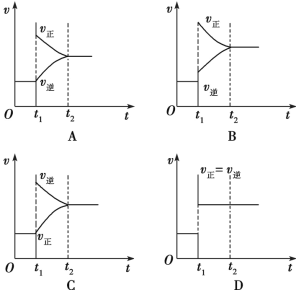
(O~t1:v正=v逆;t1时改变条件,t2时重新建立平衡)
A. 增大氧气的浓度 B. 增大压强 C. 升高温度 D. 加入催化剂
难度: 中等查看答案及解析
-
可逆反应mA(g)
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是

A. m>n,Q>0 B. m>n+p,Q>0 C. m<n+p,Q<0 D. m>n,Q<0
难度: 中等查看答案及解析
-
25℃时,水的电离可达到平衡:H2O
H++OH–;△H>0,下列叙述正确的是
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量稀硫酸,c(H+)增大,Kw不变
D. 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
难度: 中等查看答案及解析
-
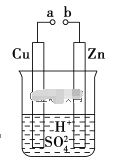
如图所示装置,电流表G发生偏转,同时X极逐渐变粗,Y极逐渐变细,Z是电解质溶液,则X,Y,Z应是下列各组中的

A. X是Zn,Y是Cu,Z为稀H2SO4
B. X是Cu,Y是Zn,Z为稀H2SO4
C. X是Fe,Y是Ag,Z为稀AgNO3溶液
D. X是Ag,Y是Fe,Z为稀AgNO3溶液
难度: 简单查看答案及解析
-
常温下,下列有关叙述正确的是
A. Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B. NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C. pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4三种溶液中,c(NH4+)大小顺序:②>①>③
D. 10mL pH=12的氢氧化钠溶液中加入pH=2的CH3COOH至pH刚好等于7,所得溶液体积V (总)≥20mL
难度: 困难查看答案及解析
-
在用Zn、Cu片和稀H2SO4组成的原电池装置中,经过一段时间工作后,下列说法中正确的是
A. 锌片是正极,铜片上有气泡产生 B. 电流方向是从锌片流向铜片
C. 溶液中H2SO4 的物质的量减少 D. 电解液的PH保持不变
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应: 2A(g)+B(g)
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法正确的是( )
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应平均速率为0.3 mol·L-1·s-1
③2 s时物质A的转化率为70%④2 s时物质B的浓度为0.7 mol·L-1
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是
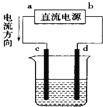
A. 电解过程中,d电极质量增加 B. 电解过程中,氯离子浓度不变
C. a为负极,b为正极 D. a为阳极,b为阴极
难度: 中等查看答案及解析
-
根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是
A.
 B.
B. 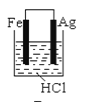 C.
C. 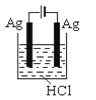 D.
D. 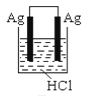
难度: 简单查看答案及解析