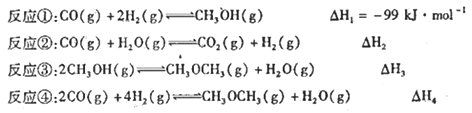-
水煤气 (主要成分CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s) + H2O(g) CO (g) +H2 (g);△H =+131.3kJ•mol-1
CO (g) +H2 (g);△H =+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
| 容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | V正、V逆比较 |
| I | 0.06 | 0.60 | 0.10 | V正=V逆 |
| II | 0.06 | 0.50 | 0.40 | (_________) |
| III | 0.12 | 0.40 | 0.80 | V正<V逆 |
| IV | 0.12 | 0.30 | _________ | V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为___________;向该容器中补充 a mol 炭,水蒸气的转化率将____________(填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为_____________。
-
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s) + H2O(g)  CO (g) +H2 (g) △H= +131.3 kJ•mol-1
CO (g) +H2 (g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡____________(向左移 / 向右移 / 不移动)。
/ 不移动)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有___________(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C (s) + H2O(g)  CO (g) +H2 (g),达到平衡时测得K= 1,则此温度下H2O(g)的转化率为________________
CO (g) +H2 (g),达到平衡时测得K= 1,则此温度下H2O(g)的转化率为________________
(5)己知:① C (s) + H2O(l)  CO (g) +H2 (g) △H1
CO (g) +H2 (g) △H1
② 2CO(g) + O2(g) = 2CO2 (g) △H 2
③ H2O (l)= H2 (g) +1/2 O2 (g) △H 3
则2C (s) + 2O2 (g) = 2CO2 (g)的△H = _____________________。
-
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s) + H2O(g)  CO(g) +H2(g) △H=+131.3 kJ·mol-1。
CO(g) +H2(g) △H=+131.3 kJ·mol-1。
(1)该反应的平衡常数K随温度的升高而___________(选填“增大”“ 减小”或“不变”)
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡____________(选填“向左移”“向右移”或“不移动”)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有___________(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+ H2O(g)  CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为_____。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为_____。
(5)己知:① C(s)+H2O(l) =CO(g)+H2(g) △H1
② 2CO(g)+O2(g)=2CO2 (g) △H2
③ H2O (l)=H2 (g)+1/2 O2 (g) △H3
则C(s)+O2 (g)=CO2 (g)的△H=_____________________。
(6)若设计以一氧化碳为燃料的碱性燃料电池,则正极为通入_______(填化学式)的一极,其电极反应式是:__________________________________________________。
-
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s) + H2O(g) CO(g) +H2(g) △H=+131.3 kJ·mol-1
CO(g) +H2(g) △H=+131.3 kJ·mol-1
(1)该反应的平衡常数K随温度的升高而___________(选填“增大”“ 减小”或“不变”)
(2)上述反应达到平衡后,将体系中的C(s)部分移走,平衡____________(选填“向左移”“向右移”或“不移动”)。
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有___________(填序号)。
A.单位体积内每消耗1 mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0 mol H2O(g)和足量的炭充入2 L的密闭容器中,发生如下反应,C(s)+ H2O(g) CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________________。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为________________。
(5)己知:① C(s)+H2O(l) CO(g)+H2(g) △H1
CO(g)+H2(g) △H1
② 2CO(g)+O2(g)=2CO2 (g) △H2
③ H2O (l)=H2 (g)+1/2 O2 (g) △H3
则C(s)+O2 (g)=CO2 (g)的△H=_____________________。
-
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)═CO (g)+H2 (g)△H=+131.3kJ•mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡______(向左移/向右移/不移动).
(3)上述反应在t时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
(5)CO和H2可合成甲醇.直接甲醇燃料电池(DMFC)由甲醇负极、氧正极和质子交换膜构成.在催化剂作用下甲醇被氧化为水和二氧化碳.甲醇用完后,只要补充甲醇就可以继续使用.因此,DMFC用作笔记本电脑、汽车等的能量来源时,它能够实现污染物的“零排放”. DMFC的正极电极反应式为______,DMFC的总反应式为______.

-
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得 :
:
C(s)+H2O(g) CO(g)+H2(g)△H=+131.3kJ•mol-1
CO(g)+H2(g)△H=+131.3kJ•mol-1
(1)该反应的化学平衡常数表达式K= ,若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),H2O(g)的平衡转化率为
(2)对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
(3)上述反应达到平衡后,移走体系中部分C(s),平衡 ,将产生的CO全部移走,平衡 (以上两空选填“向左移”、“向右移”、“不移动”)。
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中 继续画出t1时刻之后正反应速率(ν正)随时间的变化:
继续画出t1时刻之后正反应速率(ν正)随时间的变化:
增大容器体积(用实线表示) ②升高温度(用虚线表示)
-
水煤气(CO 和H2)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得:C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol
CO(g)+H2(g) △H=+131.3kJ/mol
⑴该反应的平衡常数的表达式为:_________________;升高温度,K值将 ;容器中气体的平均相对分子质量将 。(填“增大”、“减小”或“不变”)。
⑵上述反应达到平衡后,将体系 中的C(s)部分移走,平衡将 (填序号)。
中的C(s)部分移走,平衡将 (填序号)。
A.向左移 B.向右移 C.不移动
⑶下列事实能说明该反应在一定条件下已达到平衡状态的有 (填序号)。
A.单位体积内每消耗1molCO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
⑷上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在图中继续画出t1时刻后c(CO)随时间的变化曲线:
①缩小容器体积(用实线表示)。
②降低温度(用虚线表示)。

⑸某温度下,将4.0mol H2O(g)和足量的炭充入2L的密闭容器中,发生如下反应,C(s)+H2O(g) CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为 。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为 。
-
水煤气(CO 和H2)是合成甲醇的重要原料,它可用水蒸气通过炽热的炭层制得:C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol
CO(g)+H2(g) △H=+131.3kJ/mol
⑴该反应的平衡常数的表达式为:_________________;升高温度,K值将__________;容器中气体的平均相对分子质量将_____________。(填“增大”、“减小”或“不变”)。
⑵上述反应达到平衡后,将体系中的C(s)部分移走,平衡将___________(填序号)。
A.向左移 B.向右移 C.不移动
⑶下列事实能说明该反应在一定条件下已达到平衡状态的有_________(填序号)。
A.单位体积内每消耗1molCO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
⑷上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在图中继续画出t1时刻后c(CO)随时间的变化曲线:________
①缩小容器体积(用实线表示)。
②降低温度(用虚线表示)。
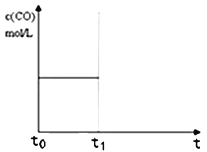
⑸某温度下,将4.0mol H2O(g)和足量的炭充入2L的密闭容器中,发生如下反应,C(s)+H2O(g) CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为____________。
CO(g)+H2(g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为____________。
-
水煤气的主要成分是氢气和一氧化碳,由水蒸气和炽热的无烟煤或焦炭作用而得.是重要的化工原料,可用于合成甲醇和甲醚等有机化合物,已知:
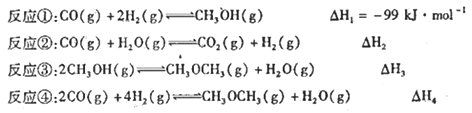
(1)△H1= ______(用△H2、△H3、△H4)。
(2)反应②的存在,可大大提高CH30CH3的产率,原因是: ________。
C0(g)和H2(g)以物质的量之比1:2混合,一定条件下在1L固定容积内发生反应①,下图表示温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系。回答下列问题:
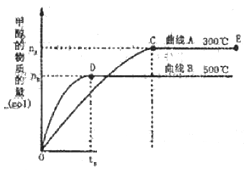
①C、D两点平衡常数KC _____KD(填>、<、= )。
②在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2下列有关该体系的说法正确的是 _______。
a. 正反应速率加快,逆反应速率也加快
b.甲醇的物质的量增加
c.重新平衡时n(H2)/n(CH3OH)增大
(4)温度为T时,向容积1L的密闭容器甲、乙中分别充入一定量的CO(g)和H20(g),发生反应②,相关数据如下:

①甲容器中,反应在t1min内的平均速率v(H2)= ____mol/(L•min)。
②乙容器中,a=_____mol。
③解释降低温度使C02平衡浓度增大的原因___________。
-
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s) +H2O(g)  CO(g) +H2(g) △H= +131.3kJ·mol-1
CO(g) +H2(g) △H= +131.3kJ·mol-1
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是 (填字母)。
a.容器中的压强不变 b.1mol H-H 键断裂的同时断裂2molH-O键
c.v正(CO)= v逆(H2O) d.c(CO) =c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+ H2(g),得到如下三组数据:
CO2(g)+ H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min |
| H2O | CO | H2 | CO |
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| | | | | | |
①该反应的逆反应为 (填“吸”或“放’’)热反应
②若实验3要达到与实验2中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是
(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol)的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量(单位为kJ·mol)的变化。

①在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使c(CH3OH)增大的是 (填字母)
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入l mol CO2和3 molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图:其中表示平衡混合物中CH3OH含量最高的一段时间是 ;如t0~t1平衡常数为K1,t2~t3平衡常数为K2,则K1 K2(填“大于”、“等于”或“小于”)。

CO (g) +H2 (g);△H =+131.3kJ•mol-1