-
2015年12月初,华北大范围遭受今年以来最严重雾霾,环保监测中心研判,本次重污染与燃煤污染排放关系最为密切。开发新能源成为当前国际能源研究的重要课题,下列属于新能源的是( )
①天然气 ②生物质能 ③地热能 ④石油 ⑤太阳能 ⑥氢能
A. ①②③⑥ B. ②③④⑥ C. ③④⑤⑥ D. ②③⑤⑥
难度: 简单查看答案及解析
-
下列反应属于氧化还原反应,而且△H>0的是 ( )
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
难度: 简单查看答案及解析
-
以下判断正确的是( )
A. CaCO3(s)=CaO(s)+CO2(g) △H=+178.5kJ・mol-1,该反应低温才能自发
B. 通常化学反应的△S 越大,越有利于反应自发进行,所以△S>0时反应必能自发
C. 某反应的△H>0,△S<0,则该反应就不能自发进行
D. 任何情况下,温度都不可能对反应的方向起决定性作用
难度: 简单查看答案及解析
-
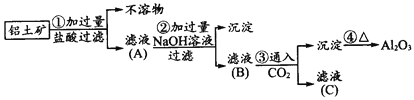
称取两份铝粉,第一份加入足量的NaOH溶液,第二份加入足量的盐酸,若放出的氢气的体积相等(同温同压)。则两份铝粉的质量比为( )
A. 1∶2 B. 1∶3 C. 3∶2 D. 1∶1
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 铝片放入氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑
B. Cu与浓硝酸反应:Cu+4H++NO3-=Cu2++NO2↑+H2O
C. 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-=Al(OH)3↓
D. AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
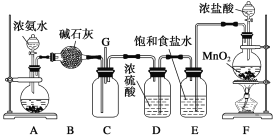
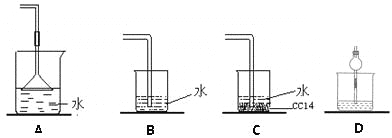
某课外实验小组设计的下列实验合理的是 ( )
A. 制备少量氨气
 B. 吸收氯化氢
B. 吸收氯化氢 C. 配制一定浓度的硫酸溶液
C. 配制一定浓度的硫酸溶液 D. 制备并收集少量NO2
D. 制备并收集少量NO2
难度: 中等查看答案及解析
-
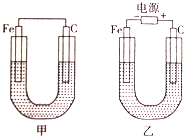
已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于氨气吸收的是( )
难度: 中等查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A. 1∶7 B. 1∶9 C. 1∶5 D. 2∶9
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A. 铝制品的耐腐蚀性强,说明铝的化学性质不活泼
B. 铁板上镀锡属于电化学防护
C. 生铁中含有碳,抗腐蚀能力比纯铁强
D. 将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀
难度: 中等查看答案及解析
-
250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g) △H=+56.76kJ/mol,自发进行的原因( )
A. 是吸热反应 B. 是放热反应
C. 是熵减少的反应 D. 熵增大效应大于焓增大的效应
难度: 中等查看答案及解析
-
在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色,化学方程式为N2O4
2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
A. 增加NO2的物质的量 B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大 D. 保持压强不变,充入N2使容器体积变大
难度: 简单查看答案及解析
-
对于在一定条件下进行的化学反应:2SO2+O2
2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是( )
A. 降低温度 B. 增大压强 C. 使用催化剂 D. 增大反应物浓度
难度: 简单查看答案及解析
-
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是 ( )
A. CuSO4 B. Na2SO4 C. CuCl2 D. NaCl
难度: 中等查看答案及解析
-
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是
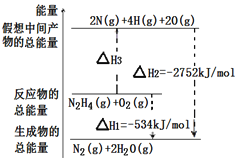
A. 194 B. 391 C. 516 D. 658
难度: 困难查看答案及解析
-
一些烷烃的标准燃烧热如下表:
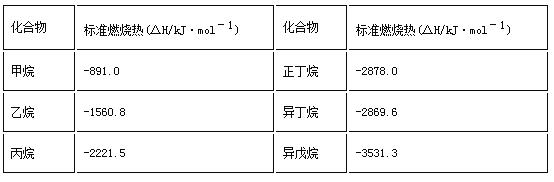
下列说法正确的是( )
A. 热稳定性:正丁烷>异丁烷
B. 正戊烷的标准燃烧热大约为:△H=–3540 kJ·mol-1
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)= 4CO2(g)+6H2O(g) △H=–1560.8 kJ·mol-1
D. 在101kPa下,甲烷的热值是891.0kJ·g-1
难度: 中等查看答案及解析
-
液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )
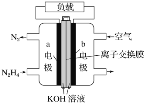
A. 该燃料电池持续放电时,正极发生氧化反应,pH变大
B. 放电时,电流从a极经过负载流向b极
C. a极的反应式:N2H4+4OH--4e-===N2↑+4H2O
D. 其中的离子交换膜需选用阳离子交换膜
难度: 中等查看答案及解析
-
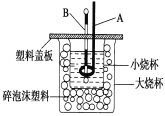
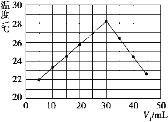
用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
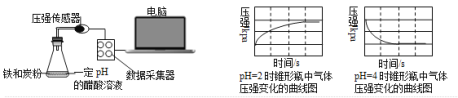
分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
难度: 困难查看答案及解析
-
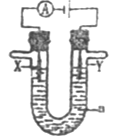
在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
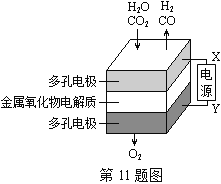
A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
难度: 中等查看答案及解析
-
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为2:1,以下说法正确的是 ( )
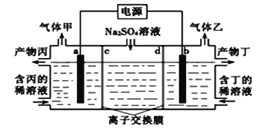
A. b电极反应式:2H2O+4e-=O2↑+4H+
B. 离子交换膜d为阴离子交换膜
C. 丙为硫酸溶液,丁为氢氧化钠溶液
D. a电极连接电源的正极作阳极
难度: 中等查看答案及解析
-
某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu。下列说法错误的是( )
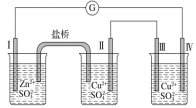
A. 电极Ⅰ发生氧化反应
B. 相同时间内,电极Ⅱ与电极Ⅳ的质量变化值相同
C. 电极Ⅲ的电极反应:4OH--4e-===O2↑+2H2O
D. 电流方向:电极Ⅳ→电流表→电极Ⅰ
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(s)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是 ( )
A. v(A)=0.15mol/(L·min) B. v(B)=0.015 mol/(L·s)
C. v(C)=0.80 mol/(L·min) D. v(D)=0.45 mol/(L·min)
难度: 简单查看答案及解析
-
X(g)+3Y(g)
2Z(g) ΔH=-a kJ·molˉ1,一定条件下,将1 mol X和3 mol Y通入2 L的恒容密闭容器中,反应10 min,测得Y的物质的量为2.4 mol。下列说法正确的是 ( )
A. 10 min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
B. 第10 min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C. 10 min内,消耗0.2 mol X,生成0.4 mol Z
D. 10 min内,X和Y反应放出的热量为a kJ
难度: 中等查看答案及解析
-
mA(g)+nB(g)
pC(g)+qQ(g)当m、n、p、q为任意整数时,达到平衡的标志是:( )
①体系的压强不再改变 ②体系的温度不再改变 ③各组分的浓度不再改变 ④各组分的质量分数不再改变⑤反应速率VA:VB:VC:VD=m:n:p:q ⑥单位时间内m mol A断键反应,同时p mol C也断键反应
A. ③④⑤⑥ B. ②③④⑥ C. ①③④⑤ D. ①③④⑥
难度: 中等查看答案及解析
-
某温度时,反应SO2(g)+1/2O2(g)
SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g)
2SO2 (g)+O2(g)的平衡常数K1应为( )
A. 2 500 B. 100 C. 4×10-4 D. 2×10-2
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
难度: 困难查看答案及解析