-
下列说法正确的是( )
A.发生了颜色变化的一定是化学变化
B.有气泡产生或固体析出的变化一定是化学变化
C.用糯米、酒曲和水制成甜酒酿一定是化学变化
D.氧化还原反应中肯定有一种元素被氧化,而另一种元素被还原
难度: 中等查看答案及解析
-
下列实验设计和结论相符的是( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定呈碱性
C.某无色溶液中加入BaCl2溶液,再加稀盐酸,沉淀不溶解,原溶液中一定有SO42﹣
D.某无色溶液中加入酚酞试液变红,该溶液一定是碱溶液
难度: 中等查看答案及解析
-
在某无色透明的碱性溶液中,能共存的离子组是( )
A.Na+、K+、SO42﹣、HCO3﹣ B.Cu2+、K+、SO42﹣、NO3﹣
C.Fe3+、K+、SO42﹣、Cl﹣ D.Na+、K+、Cl﹣、NO3﹣
难度: 中等查看答案及解析
-
下列说法或判断正确的是( )
A.可将固体或浓溶液直接在容量瓶中溶解或稀释
B.氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子
C.失去电子越多的氧化剂,其氧化性就越强
D.物质的量浓度相等的盐酸和醋酸,导电能力相同
难度: 中等查看答案及解析
-
下列实验基本操作中,主要是出于实验安全考虑的是( )
A.实验剩余的药品不能放回原试剂瓶
B.点燃可燃性气体前的验纯
C.气体实验装置在实验前进行气密性检查
D.胶头滴管不能交叉使用
难度: 简单查看答案及解析
-
离子方程式H++OH﹣═H2O所表示的反应是( )
A.所有酸和碱之间的中和反应
B.所有强酸和强碱之间的中和反应
C.所有可溶性酸和可溶性碱之间的中和反应
D.强酸溶液与强碱溶液生成可溶性盐和水的反应
难度: 中等查看答案及解析
-
已知实验室制备氯气的反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,当生成7.1gCl2时,被氧化的HCl的质量是( )
A.3.65g B.7.3g C.10.95g D.14.6g
难度: 中等查看答案及解析
-
下列离子方程式中错误的是( )
A.铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
B.碳酸氢钙溶液与盐酸反应:HCO3﹣+H+═H2O+CO2↑
C.醋酸跟氢氧化钾溶液反应:CH3COOH+OH﹣═CH3COO﹣+H2O
D.碳酸镁跟稀硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑
难度: 中等查看答案及解析
-
下列实验操作或鉴别方法可行的是( )
A.蒸发操作时,应将混合物中的水分蒸干后,才能停止加热
B.用Ba(NO3)2溶液鉴别Cl﹣、SO42和CO32﹣
C.用氨水鉴别Al3+、Mg2+和Ag+
D.可以用溶解过滤的方法从加热氯酸钾和二氧化锰的混合物中获得二氧化锰
难度: 中等查看答案及解析
-
下列所采取方法不正确的是( )
A.乙醇沸点是78.5℃,将含水酒精直接加热蒸馏可制得无水酒精
B.除去二氧化碳气体中混有的少量氯化氢气体,可以将气体通过饱和碳酸氢钠溶液
C.可以用醋酸除去锅炉中的水垢(主要成分为碳酸钙)
D.仅采用物理方法无法将晾晒海水得到的粗盐转变为精盐
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.在氧化还原反应中,非金属单质一定是氧化剂
B.某元素从化合态变为游离态时,该元素一定被还原
C.金属阳离子被还原不一定得到金属单质
D.氧化还原反应中所有元素的化合价都发生变化
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.溶液和胶体的本质区别是丁达尔效应
B.液氨、氨水属于纯净物,盐酸和豆浆属于混合物
C.胶体区别于其它分散系的本质特征是粒子大小
D.能进行“交叉分类”的就不能进行“树状分类”
难度: 简单查看答案及解析
-
如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于( )

A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
阿伏加德罗曾做过这样一个实验:一个抽空的密闭容器重Mg,在标准状况下,盛满CH4气体,称量为(M+Q)g,把CH4气体排尽,再充入SO2气体,称得的质量为( )
A.M+2Q B.M+4Q C.2Q D.2M+2Q
难度: 中等查看答案及解析
-
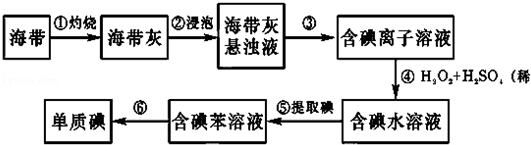
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A
B
C
D
实
验
用CCl4提取
溴水中的Br2
除去乙醇中的苯酚
从KI和I2的固体
混合物中回收I2
配制100mL 0.1000
mol•L﹣1 K2Cr2O7溶液
装
置
或
仪
器
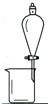
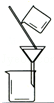


A.A B.B C.C D.D
难度: 中等查看答案及解析
-
对于2NaBr+Cl2═2NaCl+Br2反应,下列说法不正确的是( )
A.该反应既是置换反应,又是氧化还原反应
B.Cl2是氧化剂,发生还原反应
C.若有1.6g Br2生成,反应过程中转移了0.02NA个电子
D.钠元素在反应中价态不变,所以NaBr既不是氧化剂,又不是还原剂
难度: 中等查看答案及解析
-
若锌与稀硝酸反应时,其化学反应方程式为:4Zn+10HNO3=aZn(NO3)2+bM+cH2O,则a、b、c、M可能分别为( )
A.4、5、NO2 B.4、2、4、NO2 C.4、1、3、NH4NO3 D.4、3、5、NO
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温常压下,22gCO2气体中所含分子数大于0.5NA
B.1LCO2和1LCO所含分子数相同
C.等质量的O2和O3,所含的原子数一定相等
D.1mol•L﹣1的NaOH溶液中Na+数目为NA
难度: 中等查看答案及解析
-
已知Q与R的摩尔质量之比为9:22,在反应X+2Y═2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量之比为( )
A.46:9 B.32:9 C.23:9 D.16:9
难度: 简单查看答案及解析
-
G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G→Q+NaCl ②Q+H2O→X+H2 ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
则G、Q、X、Y、Z这五种化合物中氯元素的化合价由低到高的顺序为( )
A.QGZYX B.GYQZX C.GYZQX D.ZXGYQ
难度: 中等查看答案及解析
-
在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁铜都有 D.烧杯中铁铜都无
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH
2K2FeO4+6KCl+8H2O对于该反应,下列说法正确的是( )
A.该反应是置换反应 B.钾元素化合价降低
C.Fe(OH)3发生还原反应 D.Cl2是氧化剂
难度: 中等查看答案及解析