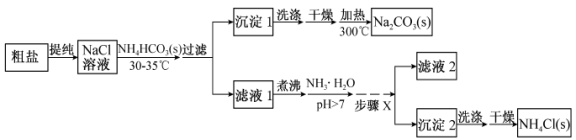
-
化学与生产、生活、社会密切相关。下列说法正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品
C.氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理
D.通入过量的空气,可以使燃料充分燃烧,同时提高热量的利用率
难度: 中等查看答案及解析
-
下列有关化学用语表达正确的是
A.二氧化硅的分子式:SiO2
B.HClO的电子式:
C.乙酸分子的球棍模型:
D.离子结构示意图
可以表示35Cl-,也可以表示37Cl-
难度: 中等查看答案及解析
-
下列有关物质的性质与其应用不相对应的是
A.MgO、Al2O3的熔点很高,可制作耐高温材料
B.NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂
C.Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
D.利用钠蒸气放电发光的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光
难度: 中等查看答案及解析
-
你认为下列数据可信的是
A.某元素原子的原子半径是111pm
B.某常见气体的密度为1.8g·cm-3
C.某澄清石灰水的浓度是2.0mol·L-1
D.用广泛pH试纸测得某溶液的pH为6.3
难度: 中等查看答案及解析
-
对下列装置图的叙述正确的是

A.装置①可用于蒸发氯化镁溶液得到无水氯化镁
B.装置②可用于铜和稀硝酸制取并收集少量NO
C.装置③可用于证明铁生锈氧气参与反应
D.苯萃取碘水中的碘后,从装置④下口放出的是碘的苯溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.1L1mol·L-1 的CH3COONa溶液中微粒数目等于2NA
B.1molCnH2n+2中含有的共价键数为(3n+1)NA
C.常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
D.标准状况下,8.0gSO3含有的分子数为0.1NA
难度: 中等查看答案及解析
-
X、Y、Z、W、Q是五种短周期元素,它们在周期表中的位置如图。 下列说法不正确的是
X
Y
Z
W
Q
A.Z与W可形成的化合物在5种以上
B.Z、W、Q三种元素形成的化合物,其水溶液一定呈中性
C.X、Y、Z、W形成的化合物的化学式可以是Y2X7W2Z
D.X与Y、Z、W均可形成原子个数比为2:1的化合物
难度: 中等查看答案及解析
-
下列说法不正确是
A.用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用胶头滴管,逐滴加入至刻度
B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
C.N2O5在四氯化碳溶液中分解为NO2和O2,可用分光光度计测定其化学反应速率
D.物质的分离提纯方法之一为“筛分:如胶体——半透膜法分离提纯;悬浊液——过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的筛子
难度: 中等查看答案及解析
-
化学是人类创造新物质的工具。下列各种物质的现代工业生产原理或过程的描述与事实不相符的是
A.用电解法制取Na、Mg、Al
B.电解熔融NaCl制Cl2
C.以硫或硫铁矿为原料通过接触法制硫酸
D.制硅:
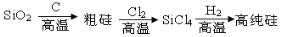
难度: 中等查看答案及解析
-
四种短周期元素的相关信息如下表所示:
元素
相 关 信 息
X
它存在多种同素异形体,可用于制作钻头、电极和纳米材料
Y
最外层电子数是内层电子数的3倍
Z
第三周期中最高价氧化物的水化物碱性最强
W
与X元素处于同一主族,工业上常用X的单质还原W的氧化物制取W单质
下列说法正确的是
A.原子半径:W>Z>Y>X
B.Y、Z两种元素只能形成化合物Z2Y
C.最低价气态氢化物的热稳定性:W>X
D.最高价氧化物对应水化物的酸性:X>W
难度: 中等查看答案及解析
-
下列叙述正确的是
A.当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握 住旋塞,将分液漏斗倒转过来,用力振荡
B.检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色
C.向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色。该实验说明FeCl3与KI反应有一定的限度
D.铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液
难度: 中等查看答案及解析
-
下列说法正确的是

A.图①中△H1=△H2+△H3
B.图②在催化剂条件下,反应的活化能等于E1+E2
C.图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线
D.图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量
难度: 中等查看答案及解析
-
在一定条件下,A、B、C、D之间可发生如下转化关系:A+B→C+D+H2O(未配平),且该过程为非氧化还原反应,则气体C不可能是
A.NH3 B.CO2 C.SO2 D.NO2
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.酸性高锰酸钾与少量双氧水反应:2MnO
+7H2O2+6H+= 2Mn2++6O2↑+10H2O
B.用石墨电极电解饱和MgCl2溶液:2Cl-+ 2H2O
2OH-+ Cl2↑+ H2↑
C.Mg(HCO3)2溶液与过量的NaOH溶液反应:Mg2++ HCO+OH—=MgCO3↓+H2O
D.向NaClO溶液中通入过量CO2;CO2+ClO—+H2O=HCO3-+HClO
难度: 中等查看答案及解析
-
已知下列四个反应的能量与反应进程变化关系如图:
①H2SO4(aq) + 2NaOH(aq) = Na2SO4(aq) + 2H2O(l)
②CH3CH2OH(g) + 3O2(g) = 2CO2 (g)+ 3H2O(g)
③N2(g) + 3H2(g) = 2NH3(g)
④Ba(OH)2(s) + 2NH4Cl (s)= BaCl2(s) + 2NH3(g) + 2H2O(l)
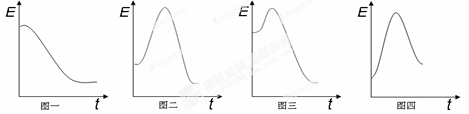
则反应②对应能量进程图可能是
A.图一 B.图二 C.图三 D.图四
难度: 中等查看答案及解析
-
下列说法正确的是
A.实验中需用0.20 mol·L-1的NaOH溶液950mL,配制时应称取NaOH的质量8.0g
B.升高NH4Cl溶液温度,其水的离子积常数和pH均增大
C.水比硫化氢稳定的原因是水分子间存在氢键
D.在pH等于2的醋酸溶液中加入少量0.01 mol·L-1的稀盐酸,溶液的pH会变小
难度: 中等查看答案及解析
-
某同学组装了如图所示的电化学装置,其中电极Ⅰ为Al,其它均为Cu,下列说法正确的是
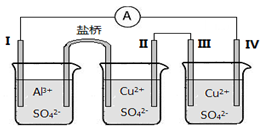
A.装Al2(SO4)3 溶液的烧杯是原电池,其余两个为电解(电镀)池
B.盐桥中电子从右侧流向左侧
C.电极Ⅱ逐渐溶解
D.电极IV的电极反应:Cu2+ + 2e- = Cu
难度: 中等查看答案及解析
-
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是

A.CO2(g)+2NH3(g)
CO(NH2)2(s)+H2O(g);ΔH<0
B.CO2(g)+H2(g)
CO(g)+H2O(g);ΔH>0
C.CH3CH2OH(g)
CH2==CH2(g)+H2O(g);ΔH>0
D.2C6H5CH2CH3(g)+O2(g)
2C6H5CH=CH2(g)+2H2O(g);ΔH<0
难度: 中等查看答案及解析
-
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol·L-1的NaOH溶液或0.10mol·L-1 的稀氨水滴定得下图。下列说法正确的是

A.由图可知曲线c为NaOH滴定硫酸
B.由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度
C.曲线b、c的滴定实验可用酚酞做指示剂
D.由图可知滴定前醋酸电离度约为1.67﹪
难度: 中等查看答案及解析
-
已知某溶液中含有下列8种离子中的5种(忽略水的电离及离子的水解):K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且5种离子的物质的量浓度相等。为了进一步探究该水溶液的组成,某同学进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是
A.无法确定溶液中是否存在Cu2+离子
B.原溶液中不含K+、Al3+、CO32-等离子
C.根据步骤②只能确定溶液中一定存在NO3-离子
D.步骤③所得到的白色沉淀共有2种钡盐
难度: 困难查看答案及解析