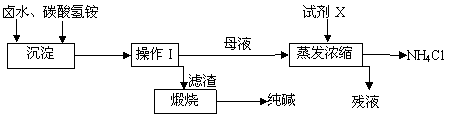
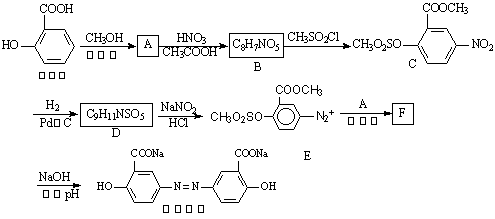
-
下列物质的用途中,利用物质氧化性的是
A.氧化铝做耐火材料 B.K、Na合金作原子反应堆导热剂
C.焦炭用于炼铁工业 D.次氯酸消毒餐具
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A.甲醛的结构式HCHO B.四氯化碳的电子式
C.环丙烷的最简式CH2 D. 的名称:2-乙基丙烷
难度: 简单查看答案及解析
-
下列物质加热熔化时破坏极性共价键的是
A.干冰 B.二氧化硅 C.晶体硅 D.氢氧化钠
难度: 简单查看答案及解析
-
下列叙述中,能证明某物质是弱电解质的是
A.熔化时不导电 B.水溶液的导电能力很差
C.属于共价化合物 D.溶液中已电离的离子和未电离的分子共存
难度: 中等查看答案及解析
-
以下物质的制备原理错误的是
A.无水氯化镁的制备:MgCl2·6H2O
MgCl2+ 6H2O
B.钴的制备:3Co3O4+8Al
9Co+4Al2O3
C.烧碱的制备:2NaCl+2H2O
2NaOH +H2↑+ Cl2↑
D.漂粉精的制备: 2Ca(OH)2 + 2Cl2→Ca(ClO)2+CaCl2+2H2O
难度: 中等查看答案及解析
-
以下性质的比较中,正确的是
A.熔点:CBr4> CCl4>CF4 B.热稳定性:HCl> H2S > H2O
C.原子半径:Cl> O>N D.密度:苯>水>四氯化碳
难度: 中等查看答案及解析
-
用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是
A.AlCl3 B. Na2CO3 C.Na2SO3 D.KMnO4
难度: 中等查看答案及解析
-
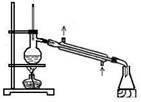
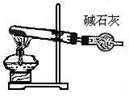
可用右图装置制取和收集的气体是
A.锌与稀硫酸反应制H2
B.浓盐酸与二氧化锰反应制Cl2
C.过氧化氢溶液与二氧化锰反应制O2
D.电石与饱和食盐水反应制C2H2
难度: 中等查看答案及解析
-
某溶液中加入铝粉能产生氢气,在该溶液中一定不能大量共存的离子组是
A.Na+、K+、Cl-、ClO- B.Cu2+、Fe2+、NO3-、SO42-
C.Na+、K+、Cl-、SO42- D.K+、NH4+、Cl-、SO42-
难度: 中等查看答案及解析
-
关于金属的腐蚀与防护,下列叙述正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.将需防腐的金属与外加直流电源的负极相连,正极与废铁相连
C.镀锌铁皮发生腐蚀时,正极的电极反应式为:Fe-2e → Fe2+
D.铁钉在潮湿空气中生锈,是因为直接发生反应:4Fe+3O2→2Fe2O3
难度: 中等查看答案及解析
-
设阿伏伽德罗常数的数值为NA,下列说法错误的是
A.18g重水所含质子总数为9NA
B.1.5 mol NO2与足量H2O反应,转移的电子数为1.5NA
C.2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
D.室温时,8gSO3 分子中氧原子的数目为 0.3NA
难度: 困难查看答案及解析
-
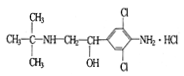 “瘦肉精”的结构可表示如图。下列关于“瘦肉精”的说法中正确的是
“瘦肉精”的结构可表示如图。下列关于“瘦肉精”的说法中正确的是A.难溶于水 B.属于芳香烃
C.不能发生加成反应 D.分子式为C12H19Cl3N2O
难度: 中等查看答案及解析
-
在实验室进行下列实验,能达到实验目的的是
A
B
C
D
分离苯和硝基苯的混合物
吸收HCl气体,并防止倒吸
以NH4Cl为原料制取NH3
制取乙烯
难度: 困难查看答案及解析
-
已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
A.Al2S3、FeS和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和 Al(OH)3 D. FeS、Al(OH)3和S
难度: 中等查看答案及解析
-
Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。已知Co2O3在酸性溶液中易被还原成Co2+,下列反应在水溶液中不可能发生的是
A.3Cl2 + 6FeI2 →2FeCl3 + 4FeI3 B.Cl2 + FeI2 → FeCl2 + I2
C.Co2O3 + 6HCl → 2CoCl2 + Cl2↑+3H2O D.2Fe3+ + 2I— →2Fe2+ + I2
难度: 中等查看答案及解析
-
右图是反应CO(g)+2H2(g) → CH3OH(g)进行过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 510 kJ
D.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 91 kJ
难度: 简单查看答案及解析