-
(原创)下列应用与盐类的水解无关的是
A.纯碱溶液可去除油污
B.用NaHCO3溶液和Al2(SO4)3溶液可以制作泡沫灭火剂
C.TiCl4溶于大量水加热制备TiO2
D.用锌粒与稀硫酸反应制取氢气时滴加少量CuSO4溶液
难度: 简单查看答案及解析
-
(原创)常温下,下列各组离子在指定条件下能大量共存的是
A.弱碱性溶液中:Na+、K+、Cl一、HCO3一
B.无色透明的酸性溶液中:Al3+、NH4+、Cl‾、HCO3‾
C.pH=1的溶液中:ClO一、SO42一、Fe2+、K+
D.由水电离的c(OH一)=10-14mol·L一1的溶液中:CH3 COO一、SO42一、Na+、NH4+
难度: 中等查看答案及解析
-
(原创)下列有关实验的说法正确的是
A.用pH试纸测双氧水的pH
B.用酸式滴定管量取20.00 mL酸性K2Cr2O7溶液
C.用托盘天平称取 5.85 g NaCl晶体
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
难度: 简单查看答案及解析
-
下列各选项所描述的两个量中,前者一定大于后者的是
A.NH4NO3溶液中NH4+和NO3-的数目
B.纯水在 80℃和 25℃时的pH
C.pH与体积都相同的氨水和NaOH溶液分别用0.1 mol·L-1盐酸恰好中和,所需的盐酸体积
D.相同温度下,pH =12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-)
难度: 中等查看答案及解析
-
(原创)下列表达式正确的是
A.CH3 COOH溶液中CH3 COOH的电离:CH3 COOH = H + + CH3 COO—
B.用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2Cl-
C.NaHCO3溶液中HCO3一的水【解析】
HCO3一+ H2 OH3 O + + CO32一
D.将FeCl3溶液滴入Na2CO3溶液中:2Fe3+ + 3 CO32‾ + 3 H2 O = 2Fe(OH)3 ↓+ 3 CO2↑
难度: 中等查看答案及解析
-
(原创) 常温下,物质的量浓度相等的下列溶液pH由大到小的顺序是
A.Na2CO3、CH3COONa、KCl、NH4NO3、NaHSO4
B.Na2CO3、CH3COONa、NaHSO4、NH4NO3、KCl
C.Na2CO3、KCl、NH4NO3、NaHSO4、CH3COONa
D.Na2CO3、NH4NO3、CH3COONa、NaHSO4、KCl
难度: 中等查看答案及解析
-
已知Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒属于一个氧化还原反应中的反应物和生成物。下列叙述中不正确的是
A.还原产物为NH4+
B.氧化剂与还原剂的物质的量之比为1∶8
C.Fe3+属于反应物, Fe2+属于生成物
D.若把该反应设计为原电池,则负极反应为Fe2+-e- = Fe3+
难度: 中等查看答案及解析
-
如图所示,隔板K1固定不动,活塞K2可自由移动。T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)
2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列说法中不正确的是
A.反应达到平衡时N2的转化率:M<N
B.H2的体积分数:M<N
C.NH3的浓度:M<N
D.该反应在T℃时的平衡常数K:M=N
难度: 困难查看答案及解析
-
下列图像正确的是

难度: 中等查看答案及解析
-
某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示。

下列判断正确的是
A.该温度下, Ksp[Fe(OH)3] >Ksp[Cu(OH)2]
B.c、d 两点代表的溶液中c(H+) 与c(OH-) 乘积不相等
C.Cu(OH)2在c点比在d点代表的溶液中溶解程度小
D.加适量浓NH3·H2O可使溶液由a点变到b点
难度: 困难查看答案及解析
-
(原创)常温下,0.1 mol/L CH3COONa溶液pH= 9,则下列说法正确的是
A.加入少量NaOH固体后溶液pH小于9
B.加水稀释,CH3COONa水解程度增大,c(OH-)增大
C.该溶液水电离出的c(OH-)== 10-9
D.CH3COOH在常温下Ka数值约为1×10-3
难度: 中等查看答案及解析
-
一定温度下,向300 mL 1 mol/L的NaOH溶液中通入b mol CO2,下列说法正确的是
A.通入CO2过程中溶液的Kw减小
B.当b= 0.2时,所得溶液中部分离子浓度关系为:c (HCO3-) > c (CO32-) > c ( OH-) > c (H+)
C.b= 0.3与b= 0.15时,所得溶液中的微粒种类不相同
D.当恰好生成NaHCO3时,溶液中存在:c(Na+)+c(H+)==c(HCO3-)+c( OH-)
难度: 极难查看答案及解析
-
下列说法正确的是
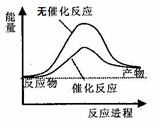
A.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
B.若 2C(s)+O2(g)=2CO(g) △H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.右图可表示水分解过程中的能量变化
D.已知:Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g) △H=-a kJ/mol,
Ⅱ:
且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ
难度: 困难查看答案及解析
-
(原创) 25℃时,向V mL PH= a的稀硫酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中2c( SO42— ) = c(Na+),则a+b的值是
A.13 B.14 C.15 D.不能确定
难度: 中等查看答案及解析
-
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如右图所示,下列说法正确的是
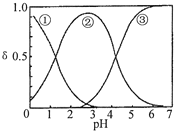
A.曲线①代表的粒子是HC2O4-
B.0.1 mol•L-1 NaHC2O4溶液中:c(Na+)=c(C2O42-)+c(H2C2O4)+c(HC2O4-)
C.pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D.在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(Ca2+)不变, c(C2O42-)将减小。(CaC2O4难溶于水)
难度: 困难查看答案及解析
-
向2L密闭容器中加入1 mol NO和1 mol活性炭,发生反应:
2NO(g)+C(s)
N2(g)+CO2(g) ΔH=﹣213.5 kJ/mol,达到平衡时数据如下:
温度/℃
n(活性炭)/mol
n(CO2)/mol
T1
0. 70
_______
T2
_______
0.25
下列说法不正确的是
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K=9/16
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2)/c(NO)不变
难度: 困难查看答案及解析