-
(原创) 酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1) 氨水是中学常见碱
① 下列事实可证明氨水是弱碱的是 (填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0. 1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0. 1mol·L-1氯化铵溶液的pH为5
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

① 滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
| 步骤1:向2 mL 0.005 mol·L-1AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
| 步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1Fe(NO3)3溶液。 | 溶液变为红色。 |
| 步骤3:向步骤2的溶液中,继续加入5滴 3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
| 步骤4:向步骤1余下的浊液中加入5滴 3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
已知:ⅠAgSCN是白色沉淀。
Ⅱ相同温度下,Ksp(AgI)= 8.3×10‾17 ,Ksp (AgSCN )= 1.0×10‾12 。
① 步骤3中现象a是 。
② 用沉淀溶解平衡原理解释步骤4的实验现象 。
③ 向50 mL 0.005 mol•L‾1的AgNO3溶液中加入150 mL0.005 mol•L‾1的 KSCN溶液,混合后溶液中Ag+的浓度约为 mol•L‾1 。(忽略溶液体积变化)
-
酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是________(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1mol/L氨水pH为11
C.铵盐受热易分解
D.常温下,0 1mol/L氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是______(填学母序号)。
A.通入氨气 B.如入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)25℃,在0.1mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,密液pH与c(S2-
关系如下图(忽略溶液体积的变化、H2S的挥发)。
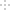
①pH=13 时,溶液中的c(H2S)+c(HS-)=______mol/L。
②某溶液含0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=____时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)聚合硫酸铁(PFS) 是水处理中重要的絮凝剂。盐基度B是衡量絮凝剂紫凝效果的重要指标,定义式为B=3n(OH-)/n(Fg3+)(n为物质的量)。为测量样品的B值。取样品mg,准确加入过量盐酸,充分反应,再加入点沸后冷却的蒸馏水,以酚酞为指示剂,用cmol/L的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液VmL。按照上述步骤做空白对照试验,消耗NaOH溶液V0mL已知该样品中Fe的质量分数w,则B 的表达式为_________。
(4)常温时,若Ca(OH)2和CaWO4 (钨酸钙) 的沉淀溶解平衡曲线如图所示(已知:  =0.58)。
=0.58)。
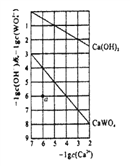
①a点表示Ca(OH)2和CaWO4________(填“是”或“否”)达到溶解平衡,说 明理由_______________。
②饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合,写出混合溶液中各离了浓度大小关系__________。
-
酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是_____________(填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是___________(填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
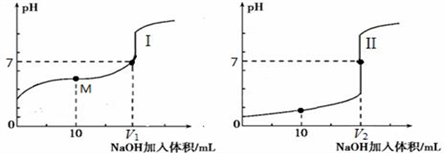
① 滴定醋酸的曲线是____________(填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是___________________。
③ V1和V2的关系:V1___________V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是___________________。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)=_____mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较________(填溶质的化学式)溶液中NH 的浓度更大,其原因是__________________
的浓度更大,其原因是__________________
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为______(填序号)。
-
电解质溶液相关问题
(1)下列事实可证明氨水是弱碱的是_______(填字母序号)。
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1 mol·L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0.1 mol· L-1氯化铵溶液的pH 为5
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于7,则溶液中c(H2CO3)_______c(CO32-)(填“>”、 “=”或“<”),原因是________(文字说明);常温下,已知0.1 mol·L-1NaHCO3溶液的pH等于8,则溶液中c(H2CO3)-c(CO32-)=_____________mol··L-1(写出计算数值结果)。
(3)现有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是_____________。
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL0.1 mol·· L-1盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
(4)用标准浓度的酸性KMnO4溶液滴定草酸(H2C2O4)溶液的测定其物质的量浓度。
① 滴定时,KMnO4溶液应装在__________(填“酸式”、“碱式”)滴定管中。
②滴定达到终点的标准是:__________________。
③滴定时所发生反应的离子方程式:_____________________。
④实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是___________。
A.称取草酸晶体(7.2g)时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失
-
下列事实可证明NH3·H2O为弱碱的是( )
A.氨水能与氯化铝溶液反应生成氢氧化铝
B.经实验测得在氨水中存在NH3·H2O分子
C.碳酸铵受热易分解
D.等浓度、等体积的氨水和氢氧化钠溶液分别与醋酸中和,二者消耗的醋酸的物质的量相同
-
下列事实可证明氨水是弱碱溶液的是( )。
A.氨水能被弱酸醋酸中和 B.铵盐受热易分解
C.氨水可以使酚酞试液变红 D.0.lmol/L氯化铵溶液的pH约为5
-
下列事实可证明氨水是弱碱的是
A 氨水能被弱酸醋酸中和 B 铵盐受热易分解
C 氨水可以使酚酞试液变红 D 0.1mol / L氯化铵溶液的pH约为5
-
下列事实可证明氨水是弱碱的是
A.氨水能被弱酸醋酸中和 B.铵盐受热易分解
C.氨水可以使酚酞试液变红 D.0.1mol / L氯化铵溶液的pH约为5
-
下列事实可证明氨水是弱碱的是( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红
D.室温下,0.1mol/L氨水溶液的pH约为11
-
下列事实可证明氨水是弱碱的是
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol/L氨水可以使酚酞试液变红
D.0.1mol/L氯化铵溶液的pH为5