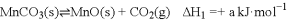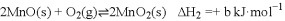-
Ⅰ.二氧化锰是化学工业中常用的氧化剂和催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3(s)+O2(g) 2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)  MnO(s) + CO2(g) ②2MnO(s) + O2(g)
MnO(s) + CO2(g) ②2MnO(s) + O2(g)  2MnO2(s)
2MnO2(s)
(1)反应①达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是 。(填字母序号)
A.平衡常数减小 B.MnCO3质量不变 C.CO2压强不变 D.MnCO3物质的量增加
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某温度下,该平衡体系的总压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,则碳酸锰热分解总反应的化学平衡常数Kp= (提示:用含P、n1、n2 的字母表达, 分压 = 总压×物质的量分数)
Ⅱ. 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的悬浊液与烟气中SO2反应可制备MnSO4·H2O。
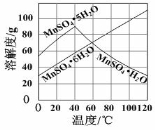
(4)已知:Ksp[Al(OH)3] =1×10-33,Ksp[Fe(OH)3] =3×10‾39,pH =7.1时Mn(OH)2开始沉淀,pH =9.4时Mg(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+( 欲使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______________________。
(5)由右图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为 Ⅰ. 。Ⅲ. 二氧化锰也是电化学的重要材料。
(6)碱性锌锰电池的总反应是:Zn + 2MnO2 + 2H2O == 2MnOOH + Zn(OH)2,该电池正极的电极反应为 。
-
二氧化锰是化学工 业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2
业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2 ②2MnO+O2
MnO+CO2 ②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,碳酸锰热分解反应的平衡常数K=____________(分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2的关系为______________。
(2)反应②在低温下能自发进行,则其ΔH______________0(填“>”、“<”或“=”)。
-
二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+ O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+ CO2;②2MnO +O2
MnO+ CO2;②2MnO +O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,碳酸锰热分解反应的平衡常数K=________(分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2的关系为_________________。
(2)反应②在低温下能自发进行,则其△H__________0 (填“>”、“<”或“=”)。
-
二氧化锰是化学工业中常用的氧化剂和催化剂。我国主要以贫菱锰矿(有效成分为 )为原料,通过热解法进行生产。
)为原料,通过热解法进行生产。
(1)碳酸锰热解制二氧化锰分两步进行:
i.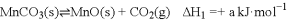
ii. 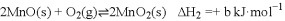
①反应i的化学平衡常数表达式 ___________。
___________。
②焙烧 制取
制取 的热化学方程式是_________________。
的热化学方程式是_________________。
(2)焙烧(装置如图1)时持续通入空气,并不断抽气的目的是________________。
(3)在其他条件不变时,某科研团队对影响 转化率的生产条件进行了研究,结果如图2、图3所示。
转化率的生产条件进行了研究,结果如图2、图3所示。
①图2是在常压( )下的研究结果,请在图2中用虚线画出
)下的研究结果,请在图2中用虚线画出 下
下 转化率与反应温度的关系图______。
转化率与反应温度的关系图______。
②常压下,要提高 的转化率,应选择的生产条件是____________焙烧
的转化率,应选择的生产条件是____________焙烧 。
。
③图3中,焙烧 时,
时, 的转化率:干空气<湿空气,原因是______________。
的转化率:干空气<湿空气,原因是______________。
-
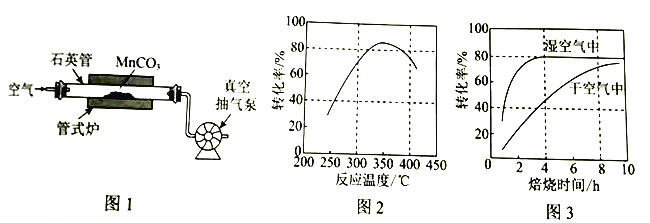
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
A. a为负极
B. 通入空气的电极反应式为O2+2e﹣+2H+═H2O2
C. 电解一段时间后,左侧溶液pH降低
D. 若生成17g双氧水,则有1molH+从左侧向右侧迁移
-
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一。SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)  4N2(g)+6H2O(g) △H<0
4N2(g)+6H2O(g) △H<0
(1)氮氧化物破坏臭氧层原理为:①NO+O3 NO2+O2 ②NO2+O
NO2+O2 ②NO2+O NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O
NO+O2。常温下反应①的平衡常数为K1,反应②的平衡常数为K2,则反应O3+O 2O2的平衡常数K =_______(用K1、K2表示)。氮氧化物在该反应中的作用是___________。
2O2的平衡常数K =_______(用K1、K2表示)。氮氧化物在该反应中的作用是___________。
(2)SCR法除NO时,投料比一定时有利于提高NO平衡转化率的反应条件是________、________。
(3)其他条件相同,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图。

①工业上选择催化剂乙的原因是______________;
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率__________(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是(________)。
A.温度高于210oC,反应放热,平衡逆移
B.催化剂活性降低
C.温度高于210oC,发生了副反应
(4)二甲醚(CH3-O-CH3)代替氟利昂作为制冷剂可减少臭氧空洞。若用二甲醚-O2燃料电池作为电源,利用电解法制备纳米Cu2O,其装置如图所示。

①上述装置中D电极应连接二甲醚燃料电池中通_______(填“CH3-O-CH3”或“O2”)的一极,该电解池中离子交换膜为_____离子交换膜(填“阴”或“阳”)。
②该电解池的阳极反应式为______________。
-
研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。
(1)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
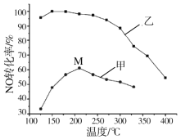
①工业上选择催化剂__________(填“甲”或“乙”)。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)。
(2)某研究小组对反应NO2+SO2 SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
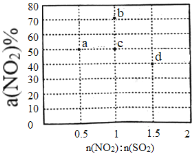
①如果将图中b点的平衡状态改变为c点的平衡状态,应采取的措施是________________。
②图中a、d两点对应的实验温度分别为T1和T2,则T1_______T2(填“>”、“=”或“<”)。
(3)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图所示。
①太阳能电池的正极为_____(填“a”或“b”)。
②生成丙烯的电极反应式是_____________________________。
③当生成标准状况下2.24L丙烯时,右侧溶液中质量减少____g。

-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
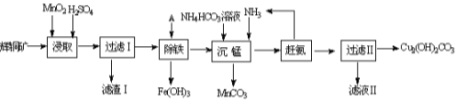
①浸取反应中氧化剂的化学式为_______;滤渣Ⅰ的成分为MnO2、S和_________(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过__________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式__________________________ 。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是____________________ (写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则导线中通过了________mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总 质量相差__________g
质量相差__________g
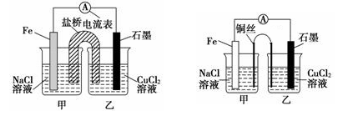
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”、“增大”或“不变”) ,乙池中石墨为________极(填“正”、“负”、“阴”或“阳”)
-
铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
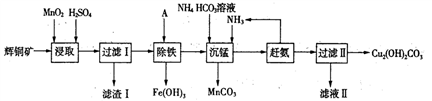
①浸取反应中氧化剂的化学式为________;滤渣I的成分为Mn02、S和_______(写化学式)。
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2] =2.2×l0-20。)
③“沉锰”(除Mn2+)过程中反应的离子方程式___________。
④滤液Ⅱ经蒸发结晶得到的盐主要是________(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装寘,盐桥内装载的是足量用饱和氯ft钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00g,则导线中通过了___mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差________g。
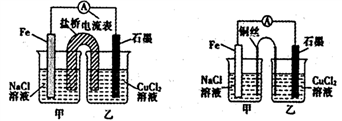
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH ___(填“减小”、“增大”或“不变”),乙池中石墨为___极(填“正”、“负”、“阴”或“阳”)
-
(13分)工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
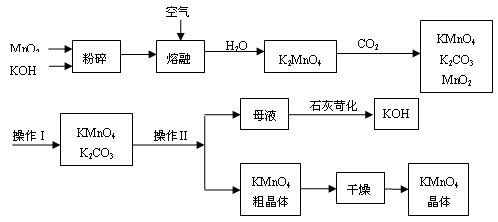
①KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a、84消毒液(NaClO溶液) b、双氧水 c、苯酚 d、75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a、浓硝酸 b、 硝酸银 c、氯水 d、烧碱
③上述流程中可以循环使用的物质有________、________(写化学式)。
④若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
⑤该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)________。a、石灰石 b、稀HCl c、稀H2SO4 d、纯碱
⑥操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
2MnO2(s)+2CO2(g)。经研究发现该反应过程为:① MnCO3(s)
MnO(s) + CO2(g) ②2MnO(s) + O2(g)
2MnO2(s)