-
下列关于化学与生产、生活的认识正确的是
A. 绿色食品就是不使用化肥农药,不含任何化学物质的食品
B. 用Ba(OH)2 处理含Cu2+的废水,可消除水中重金属离子的污染
C. 煤经过气化和液化等物理变化可转化为清洁燃料
D.
和CO2生成可降解聚合物
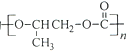 ,反应符合绿色化学的原则
,反应符合绿色化学的原则难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 含78个中子的碘原子:
I B. 氮原子的结构示意图:
C. NH4Br 的电子式:
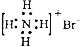 D.
D. 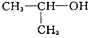 的名称是:2-羟基丙烷
的名称是:2-羟基丙烷难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. Fe比Cu活泼,FeCl3溶液可用作铜制线路板的蚀刻剂
B. SiO2熔点高,可用作半导体材料
C. Ca(C1O)2具有氧化性,可用于消菌杀毒
D. CO2 密度比空气大,可用作镁着火时的灭火剂
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
B. 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
C. 洗涤沉淀时(如图2),向漏斗中加适量水浸没沉淀并搅拌,待水滤尽后重复操作
D. 将碘酒倒入分液漏斗,加适量四氯化碳振荡后静置,可将碘萃取到四氯化碳中
难度: 中等查看答案及解析
-
a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
A. C的离子半径大于a的离子半径 B. 它们均存在两种或两种以上的氧化物
C. 元素d的简单氢化物的稳定性比c的强 D. b与氢形成的化合物中化学键都是极性共价键
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 二氧化锰与浓盐酸反应制氯气:MnO2+4HCl(浓)
Mn2++2Cl-+Cl2↑+2H2O
B. 向NH4Al(SO4)2 溶液中加入过量NaOH 溶液:Al3++4OH-=AlO2-+2H2O
C. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO3-+NO2-+H2O
D. 用惰性电极电解MgCl2 溶液:2Cl-+2H2O
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能实现的是
A. NaOH(aq)
 Cu(OH)2悬浊液
Cu(OH)2悬浊液Cu2O
B. NH3
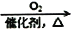 NO
NO HNO3
HNO3C. MgC12(aq)
无水MgC12
 Mg
MgD. CaCl2(aq)
 CaCO3
CaCO3 CaO
CaO难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中:Al3+、Cu2+、SO42-、Cl-
B. 中性溶液中:Al3+、NH4+、Cl-、S2-
C. c(OH-)<
的溶液中:Na+、Ca2+、ClO-、NO3-
D. 1mo/L的KNO3 溶液中:H+、Fe2+、SCN-、SO42-
难度: 简单查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是
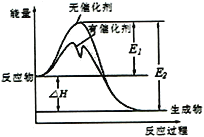
A. 该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能大于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH =-2akJ·mol-1
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
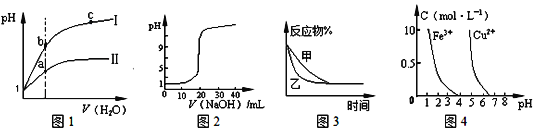
A. 图1表示同温度下,pH = 1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B. 图2表示0.1000 mol/L CH3COOH溶液滴定20.00mL0.1000mol/LNaOH溶液所得到的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
难度: 简单查看答案及解析
-
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成。下列说法正确的是
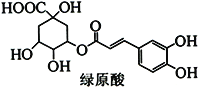
A. 绿原酸中有四个手性碳,且所有碳原子可能共平面
B. 绿原酸能发生取代、加成、消去和缩聚反应
C. 1mol奎尼酸与NaOH溶液反应,最多消耗5molNaOH
D. 1mol咖啡酸最多与5mol溴水反应
难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项
实验操作和现象
预期实验目的或结论
A
用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色
说明该食盐不是加碘盐
B
银氨溶液中滴入少量组成为C2H4O2 的液态有机物,水浴微热,有银镜出现
可确定该有机物一定是甲酸甲酯
C
向两支盛有KI3 的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀
KI3溶液中存在平衡:I3-=I2+I-
D
浓硫酸与乙醇170℃共热,制得的气体通入酸性高锰酸钾溶液,溶液紫色褪去
制得的气体产物为乙烯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
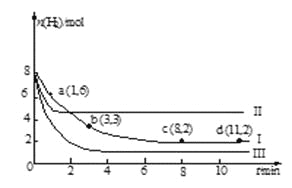
常温下,向20.00 mL 0.1000 mol·L—1(NH4)2SO4溶液中逐滴加入0.2000 mol·L—1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+ c(H+)= c(NH3·H2O )+ c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3·H2O )>c(OH-)>c(NH4+)
难度: 困难查看答案及解析
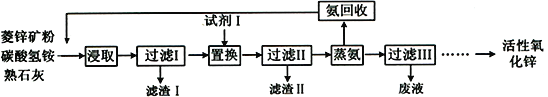



 的任意一种同分异构体的结构简式:__________。
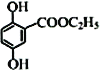
的任意一种同分异构体的结构简式:__________。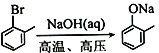 。水杨酸乙酯(
。水杨酸乙酯(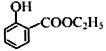 )广泛应用于日用香皂等,根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___________________。
)广泛应用于日用香皂等,根据已有知识并结合相关信息,写出以苯、乙醇为原料制备水杨酸乙酯的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)___________________。