-
化学与人类生产、生活密切相关,下列有关说法正确的是
A. 向海水中加入明矾可以解决“海水淡化危机”的问题
B. 煎炸食物的花生油、牛油都属于可皂化的饱和酯类
C. 现代工业生产中芳香烃主要来源于石油在一定条件下结构的重新调整和煤的干馏
D. 烟花的制作常加入含有铂、铁、钾、钙、铜等金属发光剂、燃放时呈现美丽的颜色
难度: 中等查看答案及解析
-
下列有关化学用语表述正确的是
A. 铁的原子结构示意图:
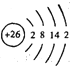
B. 乙醛的结构简式:CH3COH
C. CH3COOH电离平衡常数表达式;Ka=c(H+)·c(CH3COO-)
D. 氨气的球棍模型:
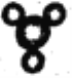
难度: 困难查看答案及解析
-
化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是
A. 氢气与过量的碘蒸气(500℃)
B. 铝片与过量浓硝酸(常温)
C. 铜粉与过量浓硝酸(常温)
D. 浓硫酸与过量铜片(共热)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol N2与0.3 mol H2 在一定条件下充分反应,生成的气体分子数为0.2NA
B. 15g冰醋酸和葡萄糖的混合物,含有的原子数为2 NA
C. 5.6 g铁与足量稀盐酸反应,产生2.24 L气体
D. 300 mL2 mol/L乙醇水溶液中所含H原子数为3.6 NA
难度: 困难查看答案及解析
-
有关甲苯和
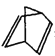 叙述不正确的是
叙述不正确的是A. 二者互为同分异构休
B. 甲苯最多13个原子共面
C. 在一定条件下都能与H2发生加成反应
D. 一氯代物都有4种
难度: 中等查看答案及解析
-
分类思想是研究化学的常用方法,下列分类叙述正确的是
A. 既有单质参加又有单质生成的反应一定是氧化还原反应
B. 淀粉、纤维素、油脂均属于天然高分子
C. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D. 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A. 纯碱可用于去油污:CO32-+2H2O
2OH-+H2CO3
B. 醋酸去水垢:2H++CaCO3=Ca2++CO2↑+H2O
C. 工业制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D. 实验室制备氢氧化铝:A13++3NH3·H2O=Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
下列有关表述正确的是
A. 同位素的性质完全相同
B. H2O分子比较稳定,是因为水分子间的作用力比较大
C. 在船身上装锌块来避免船体遭受腐蚀;是牺牲阳极的阴极保护法
D. 配制1L 1mol/L NaCl溶液,可用托盘天平称取5.85g的NaCl固体
难度: 中等查看答案及解析
-
下列表格中的除杂试剂及方法均正确的是
选项
物质(杂质)
除杂试剂
除杂方法
A
Al2O3(SiO2)
NaOH
过滤
B
溴水(I2)
CCl4
萃取、分液
C
C2H5OH(CH3COOH)
CaO
蒸馏
D
C2H6(C2H4)
H2
---
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
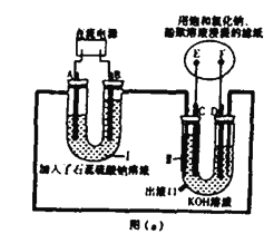
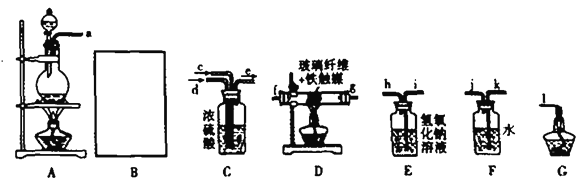
侯氏制碱法的原理是将二氧化碳通入到溶有氨气的饱和食盐水中发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。若实验室根据此原理制备少量的NaHCO3,实验包括:制取氨气-制取NaHCO3-分离NaHCO3-干燥NaHCO3四个步骤。下列实验选用的主要仪器不正确的是
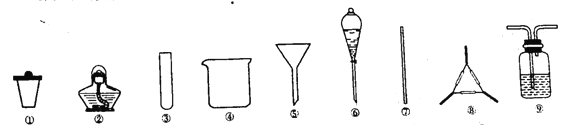
A. 制取氨气,选用②③ B. 制取NaHCO3,选用⑨
C. 分离NaHCO3,选用④⑤⑦ D. 干燥NaHCO3,选用①⑦⑧
难度: 中等查看答案及解析
-
下列有关实验操作、现象及结论均正确的是
选项
实验操作
主要现象
结论
A
取绿豆大小一块钠投入硫酸铜溶液中
有气体和红色固体产生
钠比铜活泼,能置换出铜
B
将二氧化硫通入高锰酸钾溶液中
溶液紫色褪去
二氧化硫有漂白性
C
向溶液中先加入氯水,再加入KSCN溶液
溶液变红色
原溶液中存在Fe2+
D
将乙烯气体通入溴的四氯化碳溶液中
溶液橙红色逐渐变为无色
发生了加成反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、R、W原子序数依次递增,且Y原子半径在这5种原子中最小,R单质是将太阳能转化为电能的常用材料,X和R原子最外层电子数相同;W2-的最外层为8电子结构,单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是
A. 简单离子半径W>Y>Z
B. 化合物ZY和RY4化学键类型相同
C. W、R最高价氧化物均能与水反应,且生成的酸的酸性W>R
D. W的最高价氧化物对应的水化物在与X单质反应时既显氧化性又显酸性
难度: 中等查看答案及解析
-
秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是
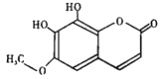
A. 1mol该有机物能与5mol H2反应
B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成;氧化,取代等反应
D. 分子中有四种官能团
难度: 中等查看答案及解析
-
下图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
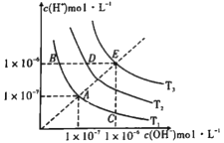
A. 图中温度:T3>T2>T1
B. 图中pH关系是:pH(B)=pH(D)=pH(E)
C. 图中五点Kw间的关系:E>D>A=B=C
D. C点可能是显酸性的盐溶液
难度: 中等查看答案及解析
-
已知“在反应物和生成物均为气体的可逆反应中,若反应物按计量系数比投料,则平衡时产物的体积分数最大”。对于2A2(g)+3B2(g)
2A2B3(g) ΔH<0的反应,在其它条件不变时,A2B3的体积分数(ψ)与A2的物质的量(n)的关系如下图所示,下列说法中正确的是
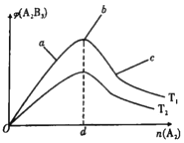
A. T1和T2的关系是:T1>T2
B. a、b、c三点都处于平衡状态;但正向速率最大的是a点
C. 在n(A2)=d的点:n(B2)=1.5d
D. a、b、c三点中:B2的转化率顺序为:b>a>c
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下几种可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集该雾霾,并经必要的预处理后得试样溶液,设计并完成了如下的实验。请根据以下的实验操作与现象,判断该同学得出的结论不正确的是
已知:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-
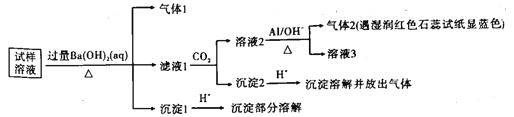
A. 试样中一定存在NH4+、Mg2+、SO42-和NO3-
B. 气体1和气体2成分一定相同
C. 试样中可能含有Al3+
D. 该雾霾中可能存在NH4NO3、NaCl和MgSO4
难度: 困难查看答案及解析
-
在2L恒容密闭容器中加入0.100molNO和2.030mol固体活性炭,发生反应:2NO(g)+C(s)
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是
温度
C(s)/mol
NO/mol
N2/mol
CO2/mol
200℃
2.000
0.0400
0.0300
0.0300
335℃
2.005
0.0500
0.0250
0.0250
A. 该反应的正反应为吸热反应
B. 反应体系在335℃时的平衡常数为0.25
C. 335℃与200℃时相比,活化分子个数、活化分子百分数、活化能及焓变均大
D. 200℃时,平衡后向恒容容器中再充入0.10molNO,再次平衡时,NO的百分含量将增大
难度: 中等查看答案及解析
-
常温下,溶液中金属离子(Mn+)的pM[pM=-lgc(Mn+)]随溶液pH变化关系如右图所示[假定c(Mn+)≦10-6mol/L认为该金属离子沉淀完全]。下列说法不正确的是
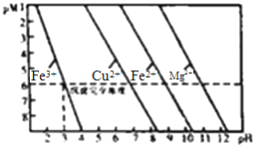
A. 四种金属的难溶氢氧化物中Ksp[Mg(OH)2]最大
B. 可以通过调节pH的办法沉淀Fe3+
C. pM、Ksp及pH之间的关系为pM=npH+lgKsp-14n
D. Fe2+和Mg2+混合溶液中滴入NaOH溶液、当Mg2+开始沉淀时,溶液中
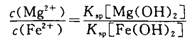
难度: 困难查看答案及解析
-
常温下,下列有关离子浓度之间的关系不正确的是
A. 将CO2通入0.1mol/LNa2CO3溶液至中性,溶液中:2c(CO32-)+c(HCO3-)=0.lmol/L
B. 浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后,pH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9)mol/L
C. 将0.2mol/LNaHCO3溶液与0.1mol/LKOH溶液等体积混合:3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
D. 已知Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5,则常温下0.1mol/LCH3COONH4中:c(CH3COO-): c(NH3·H2O)=180
难度: 困难查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的稀HNO3溶液中,收集到NO气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42- )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g.则V可能为
A. 5.5L B. 6.0L C. 8.96L D. 11.2L
难度: 困难查看答案及解析