-
草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
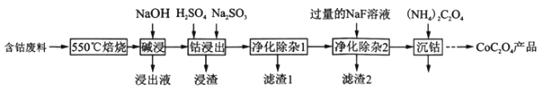
已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱。
(1)“550℃焙烧”的目的是__________
(2)“浸出液”的主要成分是_________
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________。
(4)“净化除杂1”过程中,先在40℃-50℃加入H2O2,其作用是_______(离子方程式表示):再升温至80-85℃,加入Na2CO3溶液,调pH至4.5以达到净化除杂的目的。
(5)为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液。
已知NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。
①判断NH4HC2O4溶液呈________(填“酸性”、“碱性”或“中性”)。
②将草酸钴溶液用过量稀硫酸酸化.用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液20.00mL,则草酸钴样品的纯度为____%。
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:
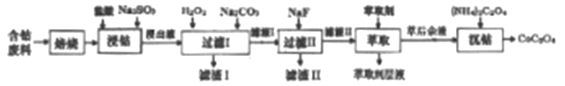
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
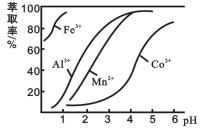
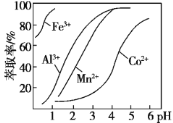
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Ni、Fe、Al2O3、CaO、炭及有机物等)制取CoC2O4的工艺流程如下:
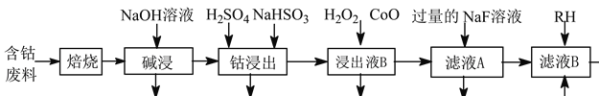
己知:①草酸钴晶体难溶于水
②RH为有机物,可用RH、有机溶剂萃取出溶液中的Ni2+
③几种金属阳离子的氢氧化物沉淀时的PH如表所示:
| Fe3+ | Co2+ |
| 开始沉淀时 | 1.9 | 7.1 |
| 沉淀完全时 | 3.7 | 9.1 |
(1)“焙烧”的目的_______。
(2)“碱浸”过程中Al2O3发生反应的化学方程式为_______。
(3) 经硫酸酸化后,“钴浸出”过程中Co3+转化为Co2+的离子方程式为_______。
(4)“浸出液B”中加入CoO并调节pH值至3.7~7.1的目的为_______。
(5) 加入NaF溶液可将钙离子转化为沉淀并过滤除去,若所得滤液中c(F-)=1.0×10-2mol·L−1,则滤液中c(Ca2+)为_______mol·L−1[已知Ksp(CaF2)=1.05×10-10]。
(6) 萃取后水层中含有大量的Co2+,将水层与酸性KMnO4溶液充分混合生成Co3+、Mn2+,理论上完全反应消耗的n(Co2+)∶n(MnO4-)=_______。
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O4)的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子以氢氧化物形式沉淀完全时溶液的pH如表(恰好沉淀完全时离子浓度等于1×10-5 mol·L-1):
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 沉淀完全时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。
回答下列问题:
(1)焙烧的目的是______;浸钴过程中Co3+转化为Co2+,反应的离子方程式为____________。
(2)加入H2O2的目的是_________;加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ的主要成分为______。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5 mol·L-1,则滤液中c(Mg2+)为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_____________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。
(5)已知含钴废料中含Co2O3的质量分数为a%,若取m g该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为________g。(列出计算式即可)
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::

(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是
_____________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则滤液中 c(Mg2+)为________________ [已知Ksp(MgF2) =7.35×10-11、Ksp(CaF2) =1.05×10-10]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
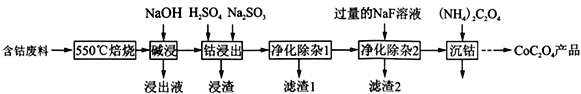
(1)“550℃焙烧”的目的是除去__________________________________;
(2)“浸出液”的主要成分是_________________________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为:____________________;
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是:(用离子方程式表示)_____;再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则滤液中c(Mg2+)为____________________ [已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2) =1.05×10-10]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0.1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________________________。
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
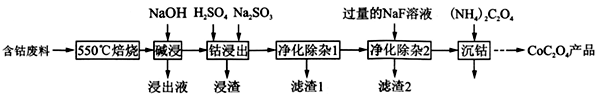
(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是
_____________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-5mol /L,则滤液中 c(Mg2+)为________________ [已知Ksp(MgF2) =7.35×10-11、Ksp(CaF2) =1.05×10-10]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图:
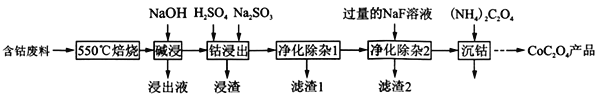
(1)“550℃焙烧”的目的是_____________________________。
(2)“浸出液”的主要成分是__________________。
(3)“钴浸出”过程中Co3+转化为Co2+,该反应的离子方程式为_________________________。
(4)“净化除杂1”过程中,先在40~50℃加入H2O2,再升温至80~85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是__________________。
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0-6mol/L,则滤液中 c(Mg2+)为__________________。[已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10]
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵溶液,再用过量稀硫酸酸化,用0.1000mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液24.00mL,则草酸钴样品的纯度为___________。
(7)取一定质量的CoC2O4·2H2O分解后的钴氧化物(Co的化合价为+2、+3),用480ml 5mol/L 盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
-
(2017·武汉市高中毕业生五月模拟考试)草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
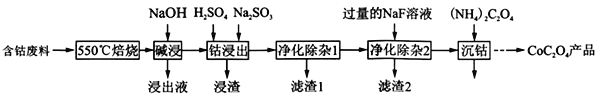
(1) “550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3) “钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是___________________________(用离子方程式表示);再升温至80 ~ 85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是_____________________。
(5) “净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0−5mol /L,则滤液中 c(Mg2+)为______________ [已知Ksp(MgF2) =7.35×10−11、Ksp(CaF2) =1.05×10−10]。
(6)为测定制得样品的纯度,现称取1.00 g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
-
草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如图
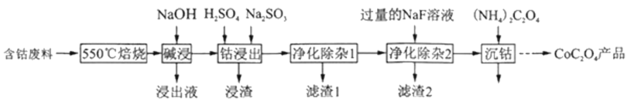
(1)“550℃焙烧”的目的是___;
(2)“浸出液”的主要成分是___;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___;
(4)“净化除杂1”过程中,先在40∼50℃加入H2O2,其作用是___(用离子方程式表示);再升温至80∼85℃,加入Na2CO3溶液,调pH至4.5,“滤渣1”主要成分的是___.
(5)“净化除杂2”可将钙、镁离子转化为沉淀过滤除去,若所得滤液中c(Ca2+)=1.0×l0−5mol/L,则滤液中c(Mg2+)为___[已知Ksp(MgF2)=7.35×10−11、Ksp(CaF2)=1.05×10−10.]
(6)为测定制得样品的纯度,现称取1.00g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00mL,则草酸钴样品的纯度为___.(保留两位小数)











