-
下列有关食品添加剂的说法正确的是
A. 木糖醇(CH2OH(CHOH)3CH2OH)可作糖尿病人的甜味剂,属于糖类
B. 常见防腐剂丙酸(CH3CH2COOH)、苯甲酸(C6H5COOH)互为同系物
C. NaNO2能使肉类较长时间保持鲜红色,因此肉类添加的NaNO2越多越好
D. 维生素C具有还原性,食品中添加维生素C既作营养强化剂又作抗氧化剂
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A. 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA
B. pH=1的硫酸溶液中含有的SO42-数目为0.05NA
C. 向1L0.3mol/L NaOH溶液中通入0.2molCO2,溶液中CO32-和HCO3-的数目均为0.1NA
D. 0.2 mol NH3与0.3 molO2在催化剂的作用下加热充分反应,所得NO 的分子数为0.2NA
难度: 中等查看答案及解析
-
丙烯酸羟乙酯(Ⅲ)可用作电子显微镜的脱水剂,可用下列方法制备:
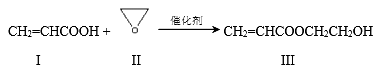
下列说法不正确的是
A. 化合物Ⅰ能与NaHCO3溶液反应生成CO2
B. 可用Br2的CCl4溶液检验化合物Ⅲ中是否混有化合物I
C. 化合物Ⅱ与乙醛互为同分异构体
D. 化合物Ⅲ水解可生成2种有机物
难度: 困难查看答案及解析
-
一种锂铜可充电电池的结构如图所示,下列说法正确的是
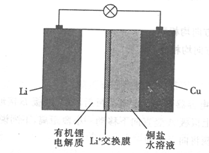
A. 放电时,正极上有金属锂析出 B. 充电时,阳极区溶液中c(Cu2+)增大
C. 放电时,负极区溶液中c(OH-)增大 D. 充电时,阴极的电极反应式为Cu2++2e-=Cu
难度: 中等查看答案及解析
-
25℃时,有pH=2的HX溶液和HY溶液各1mL ,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是
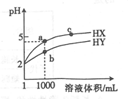
A. a、c两点对应HX的电离平衡常数:K(c)>K(a)
B. a、b两点对应的溶液中:c(X-)>c(Y-)
C. 等物质的量浓度的NaX和NaY的混合溶液中:c(HY)>c(HX)
D. 分别向10mL0.1mol/LHX溶液和10mL 0.1mol/L HY溶液中滴加同浓度的氢氧化钠溶液至pH = 7,消耗氢氧化钠溶液较少的是HX
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验操作
现象
结论
A
向FeCl3饱和溶液中滴入足量浓氨水,并加热至沸
生成红褐色透明液体
得到Fe(OH)3胶体
B
用坩埚钳夹住点燃的镁条伸入二氧化碳气体中
镁条剧烈燃烧
二氧化碳作还原剂
C
将二氧化硫气体通人Ba(NO3)2溶液中
有白色沉淀生成
H2SO3与Ba(NO3)2发生复分解反应生成BaSO3
D
向盛有1mLO.lmolFeBr2溶液的试管中滴入几滴KSCN溶液和1 mL苯,然后加入几滴氯水,并缓缓振荡
下层溶液变红,上层溶液无明显变化
还原性:Fe2+>Br-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素Z、W、X、Y的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1mol/L t溶液与0.1mol/L u溶液的pH 均为1。
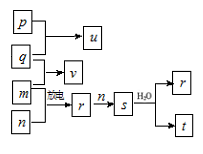
下列说法正确的是
A. 原子半径:X<Y<Z
B. 元素的非金属性:X>Y>W
C. v能分别与u、t反应生成离子化合物
D. Z的氧化物对应的水化物均为强酸
难度: 困难查看答案及解析
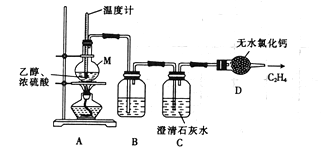
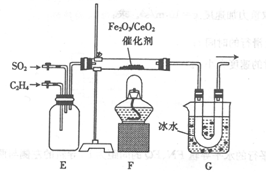

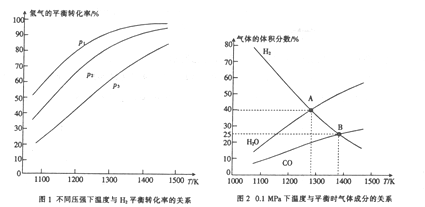
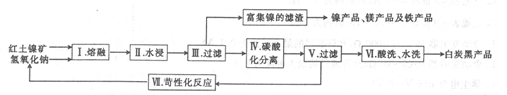
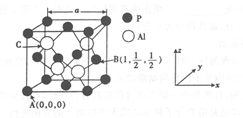
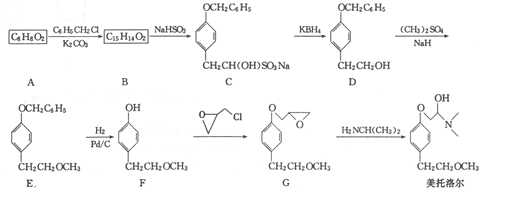
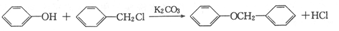
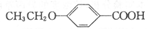 )的合成路线:______________。
)的合成路线:______________。