-
铅及其化合物用途非常广泛,已知铅(Pb)与硅同主族且Pb 比Si 多3个电子层。回答下列问题;
(1)铅位于元素周期表的第_________周期________族。
(2)难溶物PbSO4溶于CH3COONH4 溶液可制得(CH3COO)2Pb[(CH3COO)2Pb 易溶于水],发生的反应为PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4,说明(CH3COO)2Pb是________________(填“强”或“弱”)电解质。
(3)铅蓄电池充放电原理为Pb+PbO2+2H2SO4 2PbSO4 +2H2O,其中工作“B”为_________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是_______________________________________(用化学方程式表示)。
2PbSO4 +2H2O,其中工作“B”为_________(填“放电”或“充电”);电解质不能用浓盐酸,否则电池失效并放出大量的氯气,其原因是_______________________________________(用化学方程式表示)。
(4)将PbO2 加入硝酸酸化的Mn(NO3)2溶液中,搅拌后溶液显紫红色。则每反应1mol Mn(NO3)2转移_________________mol 电子。
-
NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g)  N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g)  2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g)  8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________(用含△H1和△H2的代数式表示)。
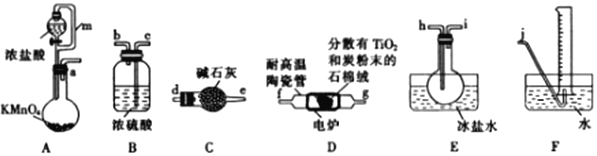
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H________(填“>”或“<”)0,N2H4发生分解反应的化学方程式为___________。
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。
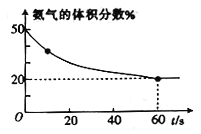
① 0~60s内,反应速率v(CO2)=________mol/(L·s)
② T℃时,该反应的化学平衡常数K=________。
-
消毒剂在生产、生活中有重要的作用,常见的含氯消毒剂有NaClO2、NaClO、ClO2 和Cl2
回答下列问题:
(1)NaClO2所含的化学键类型有________________。
(2)消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是________________(用化学方程式表示)。
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是________________。
(4)自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
b. 2S2O32-+I2==S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈___________(填“蓝色”或“无色”)
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=___________mg·L-1
-
工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:
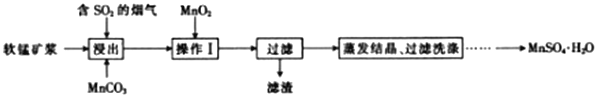
已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、_____________________。
(2)操作Ⅰ的目的是_______________________和调节溶液的PH 至3~4。检验过滤后的滤液中是否含有Fe3+的操作是___________________________________________________________________。
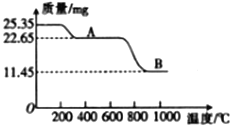
(3)通过煅烧MnSO4·H2O 可制得软磁铁氧体材料(MnxO4),在不同温度下煅烧MnSO4·H2O时剩余质量变化的曲线如图所示。根据图中数据可得MnxO4中x 的值为______________。A到B过程中分解得到的气体中SO2与SO3的物质的量之比为2∶1,写出该过程中发生反应的化学方程式:______________
-
硼、砷、锑的化合物用途非常广泛。回答下列问题:
(1)基态砷原子的价电子轨道表达式(电子排布图)为_______________,其未成对电子所在原子的轨道轮廓图形为____________________。
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于____________晶体,AsF3的沸点(60.4℃)比SbF3的沸点(376℃)低,其原因是____________________________________。
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有____________________________________。
(4)与BF3互为等电子体的分子和离子分别为_______________(各举1例);已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则BF3中的大π键应表示为_________________。
),则BF3中的大π键应表示为_________________。
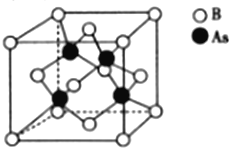
(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有_________个,与每个硼原子紧邻的硼原子有_________个,若其晶胞参数为bpm,则其晶体的密度为_________________(列出表达式,设NA为阿伏加德罗常数的数值)g·cm-3。
-
β一受体阻滞剂盐酸艾司洛尔(F)的一种合成路线如下:


已知:
回答下列问题:
(1)A的化学名称是____________;F中含氧官能团的名称是___________________。
(2)由B生成C的反应类型为____________,由D生成E的反应类型为____________。
(3)B的结构简式为____________。
(4)由C生成D的化学方程式为____________。
(5)三取代芳香族化合物X是E的同分异构体,1molX与足量的NaHCO3反应可生成44.8L(标准状况)CO2,其核磁共振氢谱显示有5种不同化学环境的氢,且其峰面积之比为9:2:2:2:1。写出2种符合要求的X的结构简式:________________________________________________。
(6)写出以苯甲醇和丙二酸为原料制备 的合成路线_____________(其他无机试剂任选)。
的合成路线_____________(其他无机试剂任选)。
(b)、
(d)、CH≡C-CH=CH2(p)的分子式均为C4H4。下列说法正确的是








 的合成路线_____________(其他无机试剂任选)。
的合成路线_____________(其他无机试剂任选)。