-
硼、砷、锑的化合物用途非常广泛。回答下列问题:
(1)基态砷原子的价电子轨道表达式(电子排布图)为_______________,其未成对电子所在原子的轨道轮廓图形为____________________。
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于____________晶体,AsF3的沸点(60.4℃)比SbF3的沸点(376℃)低,其原因是____________________________________。
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有____________________________________。
(4)与BF3互为等电子体的分子和离子分别为_______________(各举1例);已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则BF3中的大π键应表示为_________________。
),则BF3中的大π键应表示为_________________。
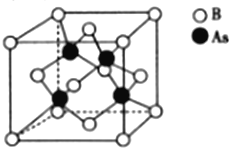
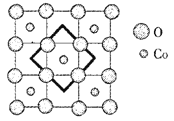
(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有_________个,与每个硼原子紧邻的硼原子有_________个,若其晶胞参数为bpm,则其晶体的密度为_________________(列出表达式,设NA为阿伏加德罗常数的数值)g·cm-3。
-
硼、砷、锑的化合物用途非常广泛。回答下列问题:
(1)基态砷原子的价电子轨道表达式(电子排布图)为_______________,其未成对电子所在原子的轨道轮廓图形为____________________。
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于____________晶体,AsF3的沸点(60.4℃)比SbF3的沸点(376℃)低,其原因是____________________________________。
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有____________________________________。
(4)与BF3互为等电子体的分子和离子分别为_______________(各举1例);已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则BF3中的大π键应表示为_________________。
),则BF3中的大π键应表示为_________________。
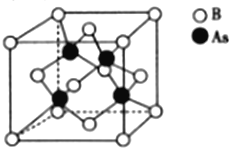
(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有_________个,与每个硼原子紧邻的硼原子有_________个,若其晶胞参数为bpm,则其晶体的密度为_________________(列出表达式,设NA为阿伏加德罗常数的数值)g·cm-3。
-
镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布图(轨道表达式)为__________,基态Mg原子电子占据最高能级的电子云轮廓图为__________形。
(2)Mg2C3与水反应可生成H2C=C=CH2,中间的碳原子杂化方式是__________,反应所涉及的元素中电负性最大的是__________(填元素符号),Mg2C3和H2C=C=CH2中均存在(填字母)__________。
A.配位键 B.σ键 C.π键 D.氢键
(3)MgO晶格能可通过图1的bom- Haber循环计算得到。
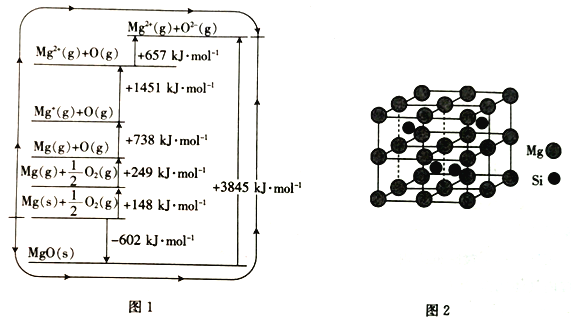
Mg的第二电离能为__________kJ·mol-1;O=O键的键能为_________kJ·mol-1;MgO的晶格能为__________kJ·mol-1。
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.94g·cm-3,NA为阿伏加德罗常数的值。
①则晶胞参数a=__________nm(列出计算式)
②Mg2Si的另一种表示中,四个Mg处于上图所示立方体中的Si的位置,则Si处于____________。
-
卤族元素及其化合物的用途非常广泛。回答下列问题:
(1)基态氯原子价电子轨道表示式(电子排布图)为___;处于最高能级电子云轮廓图形状为____。
(2) 和
和 的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
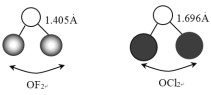
①O-F键的键长比O-Cl键的小,其原因是______。
②键角:∠FOF_____(填“>”、“<”或“=”)∠ClOCl。
(3)①试解释酸性HBrO4>HBrO3的原因_________ 。
②试解释酸性HClO3>HBrO3>HIO3的原因_________ 。
(4) 的熔点为1040℃;
的熔点为1040℃; 的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
(5)氯化亚铜晶胞结构如图所示,晶胞参数a=0.542nm。
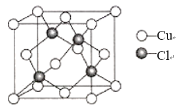
①Cu+的配位数为_____。
②氯化亚铜的密度为____ (用含NA的计算式表示)。
(用含NA的计算式表示)。
-
铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
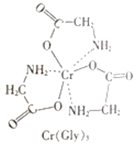
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则NO2的大
),则NO2的大 键可表示为__。
键可表示为__。
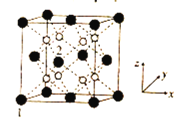
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
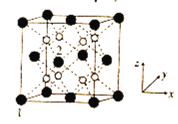
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、( ,0,
,0, ),则原子坐标为(
),则原子坐标为( ,
, ,
, )和(
)和( ,
, ,
, )间的距离为__pm。
)间的距离为__pm。
-
铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
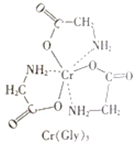
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则NO2的大
),则NO2的大 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、( ,0,
,0, ),则原子坐标为(
),则原子坐标为( ,
, ,
, )和(
)和( ,
, ,
, )间的距离为__pm。
)间的距离为__pm。
-
硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co) < I4(Fe),其原因是_______;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2) 单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3) K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
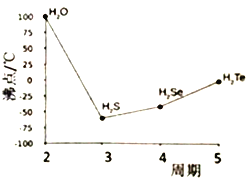
(4)S 与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。
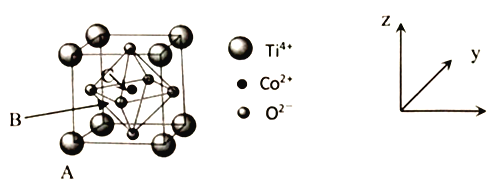
①已知A点的原子坐标参数为为(0,0,0),B点为( ,0,
,0, ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3 (列出计算表达式即可)。
-
锰的单质及其化合物的用途非常广泛.回答下列问题:
(1)基态锰原子的核外电子排布式为_______,其d轨道中未成对电子数为__________.
(2)MnO的熔点(1650℃)比MnS的熔点(1610℃)高,它们都属于___晶体。前者熔点较高的原因是_____________。
(3)锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。
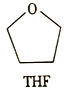
① 与Mn2+形成配位键的原子为_______(填元素符号)。
② BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
③ 写出两种与BH4-互为等电子体的分子或离子:___________。
(4)一种磁性材料的单晶胞结构如图所示。
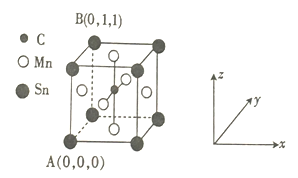
① 该晶胞中碳原子的原子坐标为________。
② Mn在晶体中的堆积方式为________(填“简单立方”“体心立方”“面心立方最密”或“六方最密") 堆积。
③ 若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ=_____。
-
锰的单质及其化合物的用途非常广泛.回答下列问题:
(1)基态锰原子的核外电子排布式为_______,其d轨道中未成对电子数为__________.
(2)MnO的熔点(1650℃)比MnS的熔点(1610℃)高,它们都属于___晶体。前者熔点较高的原因是_____________。
(3)锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。
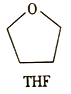
① 与Mn2+形成配位键的原子为_______(填元素符号)。
② BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
③ 写出两种与BH4-互为等电子体的分子或离子:___________。
(4)一种磁性材料的单晶胞结构如图所示。
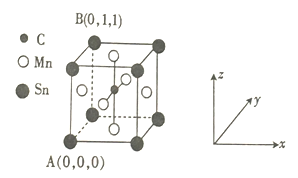
① 该晶胞中碳原子的原子坐标为________。
② Mn在晶体中的堆积方式为________(填“简单立方”“体心立方”“面心立方最密”或“六方最密") 堆积。
③ 若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ=_____。
-
钠的化合物用途广泛,回答下列问题:
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为___________,基态S原子电子占据最高能级的电子云轮廓图为___________,其中Na2S4中存在的化学键有:___________。
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是___________。
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是___________,空间构型是______________________。
(4)下表列出了钠的卤化物的熔点:
| 化学式 | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是_________________________________;
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是___________。
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为___________pm;NaH的理论密度是___________g·cm-3(保留三位有效数字)。[H—1、Na—23]
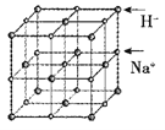
(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶跑,则x=___________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
),则BF3中的大π键应表示为_________________。
















