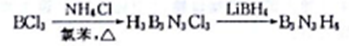-
铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
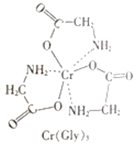
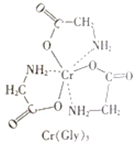
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则NO2的大
),则NO2的大 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
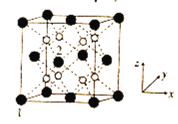
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、( ,0,
,0, ),则原子坐标为(
),则原子坐标为( ,
, ,
, )和(
)和( ,
, ,
, )间的距离为__pm。
)间的距离为__pm。
-
铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则NO2的大
),则NO2的大 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
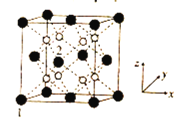
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、( ,0,
,0, ),则原子坐标为(
),则原子坐标为( ,
, ,
, )和(
)和( ,
, ,
, )间的距离为__pm。
)间的距离为__pm。
-
硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1)VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为___________
(2)B、C、N、O四种元素第一电离能由小到大的顺序为_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示:
| 卤化物 | BF3 | BCl3 | BBr3 | BI3 |
| 沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:_________________。
③制备环硼氨烷的方法如下:

BCl3、LiBH4中硼原子的杂化轨道类型依次为_________________;与B3N3H6互为等电子体的分子的结构简式为___________________。
(4)立方氮化硼的晶胞结构与金刚石结构相似(如下图),是超硬材料。
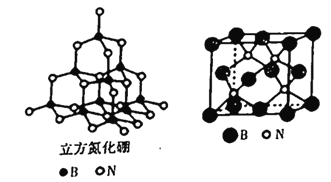
①晶胞中每个氮原子周围与其最近且等距离的硼原子有_____个;
②结构化学上常用原子坐标参数表示晶胞内部各原子的相对位置,立方氮化硼的晶胞中, B原子的坐标参数分别有:B(0,0,0),B( ,0,
,0,  );B(0,
);B(0,  ,
,  )等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
)等,则距离上述三个B原子最近且等距离的N原子的坐标参数为___________________。
③已知氮化硼晶胞边长为apm,则氮化硼晶体的密度为____g·cm-3(设NA为阿伏加德罗常数值,只要求列算式)。
-
硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1) VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为_______。
(2)B、C、N三种元素第一电离能由小到大的顺序为________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
| BF3 | BCl3 | BBr3 | BI3 |
| 沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是__________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)==NH4[BF4] (s)能够发生的原因:____________。
制备环硼氨烷的方法如下:
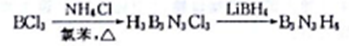
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________;与B3N3H6互为等电子体的分子的结构简式为________________。
(4)立方氮化硼的熔点为3000℃,其晶胞结构如图所示,晶胞参数a=361.5pm。
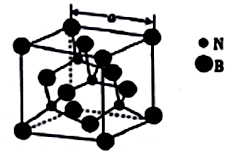
①立方氮化硼的晶体类型为_______________。
②紧邻的两个硼原子间的距离为_______(列出计算式即可) pm。
③立方氮化硼的密度为_____(列出计算式即可)g•㎝-3。
-
硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:
(1) VB2是一种导电陶瓷材料,基态钒原子的价电子排布图为_______。
(2)B、C、N三种元素第一电离能由小到大的顺序为________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
| BF3 | BCl3 | BBr3 | BI3 |
| 沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是__________________。
②用BF3分子结构解释反应BF3(g)+NH4F(s)==NH4[BF4] (s)能够发生的原因:____________。
制备环硼氨烷的方法如下:
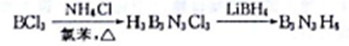
BCl3、LiBH4中硼原子的杂化轨道类型依次为_________;与B3N3H6互为等电子体的分子的结构简式为________________。
(4)立方氮化硼的熔点为3000℃,其晶胞结构如图所示,晶胞参数a=361.5pm。
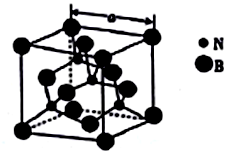
①立方氮化硼的晶体类型为_______________。
②紧邻的两个硼原子间的距离为_______(列出计算式即可) pm。
③立方氮化硼的密度为_____(列出计算式即可)g•㎝-3。
-
硼的化合物或合金在储氢、有机合成、超导等方面用途非常广泛。
(1)Mn(BH4)2是一种储氢材料,Mn2+基态核外电子排布式为___。
(2)与环硼氮六烷[分子式为(HNBH)3]互为等电子体的常见分子是___(填结构简式);推测环硼氮六烷在热水、CH3OH中的溶解性:__(填“难”或“易”)溶于热水、CH3OH。
(3)化合物X(如图所示)可由CH2CHCH2MgBr与B(OCH3)3制备。X分子中碳原子的轨道杂化类型为___;1molX分子中含σ键数目为____。
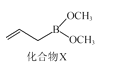
(4)YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图所示,则其化学式为___。
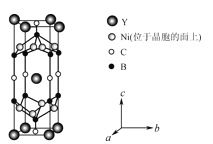
-
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为 。
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。
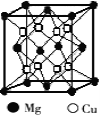
(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC-CH2CH2OH。
OHC-CH2CH2OH。
OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。
-
磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:
(1)画出基态P 原子的核外电子排布图__________。
(2) NH3比PH3 易液化的原因是_________。
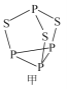
(3) P4S3可用于制造火柴,其结构如图1所示。
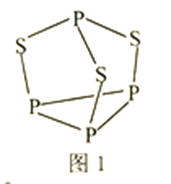
①P4S3中硫原子的杂化轨道类型为________。
②电负性: 磷_____硫(填“>”或“<”);第一电离能磷大于硫的原因是________。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有____mol 配位键。
(5)NF3的键角小于NH3的键角,其原因是____________。
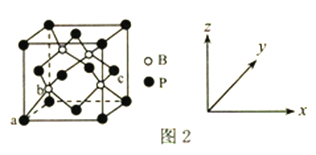
(6) 磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1, ,
, ),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
),则b点的原子坐标参数为________;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为_____g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。
-
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为___________________________________;
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为___________;

(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有___________(举2例).
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC-CH2CH2OH;
OHC-CH2CH2OH;
OHC-CH2CH2OH中碳原子杂化方式有___________,乙炔属于___________(填“极性”或“非极性”)分子.
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称溶质的化学式为___________,其中含有的化学键类型有______________________;
(6)已知铜镁互化物晶胞参数为apm,则该晶胞的密度为_______________。
-
磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。
①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
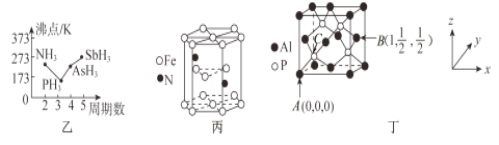
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH3<NH3,其原因是____________________;沸点:PH3<AsH3<SbH3,其原因是_____________________________________________________。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_________________。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______________。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_____________________________cm。

键可用符号
表示,其中m代表参与形成大
键的原子数,n代表参与形成大
键的电子数(如苯分子中的大
键可表示为
),则NO2的大
键可表示为__。

,0,
),则原子坐标为(
,
,
)和(
,
,
)间的距离为__pm。