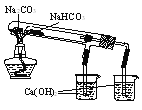
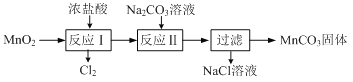
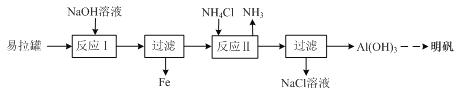
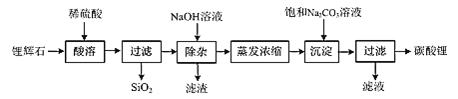
-
下列反应的离子方程式与其他三个不同的是( )
A.澄清石灰水中滴加碳酸钠溶液 B.氯化钙溶液中滴加碳酸钾溶液
C.硝酸钙溶液中滴加碳酸铵溶液 D.澄清石灰水中通入二氧化碳
难度: 中等查看答案及解析
-
下列各组物质混合后,有白色沉淀生成的是( )
A.AlCl3溶液中逐滴滴入过量氨水 B.CuCl2溶液滴加NaOH溶液
C.NaHCO3溶液中滴加NaOH溶液 D.CO2通入NaCl溶液
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.FeCl3溶液中加入铜粉:2Fe3++3Cu=2Fe+3Cu2+
B.Al2O3溶于烧碱溶液:2Al3++3O2-+2OH-=2AlO
+H2O
C.Al(OH)3溶于稀硫酸:Al(OH)3+3H+=Al3++3H2O
D.氢氧化钡溶液与硫酸溶液反应:Ba2++SO
=BaSO4↓
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.11.2 L 氢气中含有的分子数为3.01×1023
B.1 mol·L-1KClO3溶液中含K+数目为6.02×1023
C.1.4 g N2中含有的原子数目为6.02×1022
D.标准状况下,2.24 L CCl4中含有的分子数为6.02×1022
难度: 困难查看答案及解析
-
向含0.02 mol的MnO
溶液中加入0.1 mol FeSO4,恰好完全反应后Fe2+完全转化为Fe3+,则MnO
的还原产物是
A.Mn B.Mn2+ C.MnO2 D.MnO
难度: 困难查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A.钠的密度小,可用于制高压钠灯 B.Al2O3熔点高,可用于制耐高温材料
C.MnO2不溶于水,可作H2O2分解的催化剂 D.活性炭具有还原性,可用作净水剂
难度: 中等查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
A.Fe2O3
Fe(OH)3 B.Na
Na2O
C.Al(OH)3
Al2O3 D.FeCl2
FeCl3
难度: 中等查看答案及解析
-
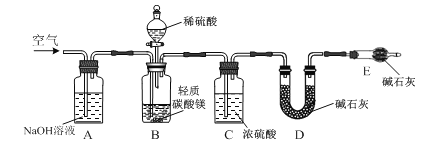
下列实验装置或操作正确的是( )
A.分液
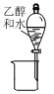 ;
;B.蒸馏
 ;
;C.转移
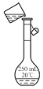 ;
;D.蒸发
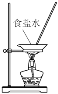
难度: 中等查看答案及解析
-
下列反应属于氧化还原反应,且HCl既不作氧化剂也不作还原剂的是( )
A.PbO2+4HCl=PbCl2+Cl2↑+2H2O B.NaOH+HCl=NaCl+H2O
C.2FeCl2+H2O2+2HCl=2FeCl3+2H2O D.Zn+2HCl=ZnCl2+H2↑
难度: 中等查看答案及解析
-
同温同压下,等体积的O3和O2相同的是( )
A.质量 B.分子数 C.原子数 D.密度
难度: 中等查看答案及解析
-
“钴酞菁”在水中可形成分散质粒子直径约2 nm的分散系,该分散系是( )
A.溶液 B.胶体 C.悬浊液 D.电解质
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.Na原子的结构示意图:
B.赤铁矿的成分:Fe3O4
C.Na2O2中钠元素化合价:+2 D.氯化钙的电离方程式:CaCl2=Ca2++2Cl-
难度: 简单查看答案及解析
-
在含有大量Fe3+、H+、SO42-的溶液中还能大量共存的离子是( )
A.Ba2+ B.OH- C.HCO3- D.NO3-
难度: 中等查看答案及解析
-
下列类型的反应一定属于氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
难度: 简单查看答案及解析
-
下列转化需要加入氧化剂才能实现的是( )
A.Cu→CuCl2 B.NO2→NO C.CO2→CaCO3 D.(NH4)2SO4→NH3
难度: 中等查看答案及解析
-
不需要使用其他试剂,仅通过溶液的相互滴加即可鉴别的溶液是( )
A.AlCl3、NaOH B.H2SO4、KOH C.NaCl、KNO3 D.MgCl2、Na2CO3
难度: 困难查看答案及解析
-
溶液X中可能含有Fe2+、Ba2+、K+、SO42-、Cl-、CO32-中的某几种,现进行下列实验:
步骤1:取少量溶液,向其中加入足量的NaOH溶液,有白色沉淀生成,沉淀很快变成灰绿色,最终变成红褐色,过滤;
步骤2:向步骤1所得滤液中加入足量BaCl2溶液,有白色沉淀生成,过滤;
步骤3:向步骤2所得滤液中加入足量稀硝酸,再滴加AgNO3溶液,有白色沉淀生成。
下列说法正确的是( )
A.步骤1所得白色沉淀为Fe(OH)3
B.溶液X中一定存在的离子有Fe2+、SO42-、Cl-
C.溶液X中一定不存在的离子是Ba2+、CO32-
D.溶液X中可能存在的离子是K+、Cl-、CO32-
难度: 困难查看答案及解析