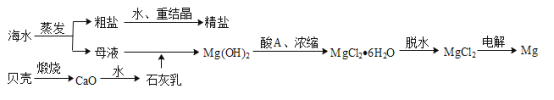
-
“诗画瘦西湖,人文古扬州”,宜居扬州城应该大力提倡( )
A.保护湿地 B.秸秆焚烧 C.炸山填湖 D.露天烧烤
难度: 简单查看答案及解析
-
人体中含量最多的物质是( )
A.氧气 B.氮气 C.水 D.氯化钠
难度: 简单查看答案及解析
-
甲烷(CH4)是常见可燃性气体,该物质属于( )
A.混合物 B.单质 C.氧化物 D.有机物
难度: 简单查看答案及解析
-
今年 7 月 1 日扬州开始实施生活垃圾“四分类”,以下属于可回收垃圾的是()
A.废旧干电池 B.废书旧报纸 C.瓜皮坚果壳 D.废弃体温计
难度: 简单查看答案及解析
-
以下属于石蜡化学性质的是( )
A.白色蜡状固体 B.可燃烧 C.密度比水小 D.熔点约 47℃—64℃
难度: 简单查看答案及解析
-
以
模型代表水分子,水电解时发生改变的微粒是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
K2CO3是常用的肥料,它属于
A.钾肥 B.氮肥 C.磷肥 D.复合肥
难度: 简单查看答案及解析
-
以下属于不可再生能源的是( )
A.石油 B.潮汐能 C.地热能 D.氢能
难度: 简单查看答案及解析
-
鱼乐宝是一种净水剂,关于其有效成分硫代硫酸钠(Na2S2O3)说法正确的是()
A.硫代硫酸钠中 S 元素为-2 价
B.硫代硫酸钠相对分子质量为 158
C.硫代硫酸钠由 7 个原子构成
D.硫代硫酸钠中含有钠单质
难度: 简单查看答案及解析
-
以下生活中常见的物质属于溶液的是( )
A.蔗糖 B.蒸馏水 C.生理盐水 D.玉米糊
难度: 简单查看答案及解析
-
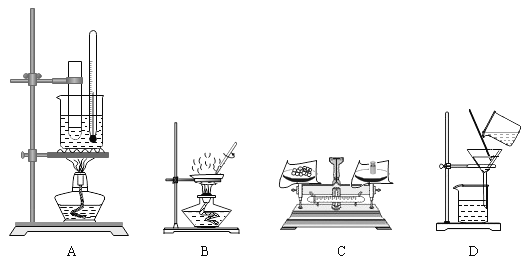
实验结束后,下列仪器放置的方法正确的是
A.
B.
 C.
C. D.
D.
难度: 简单查看答案及解析
-
以下能确定一份雨水样品是酸雨的是( )
A.紫色石蕊 B.无色酚酞 C.肥皂水 D.pH 计
难度: 简单查看答案及解析
-
实验室制氢气反应
,该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 简单查看答案及解析
-
关于水的净化、使用描述正确的是( )
A.加入明矾杀菌消毒
B.通过沙滤池除去异味
C.煮沸可以使硬水软化
D.长期饮用蒸馏水最健康
难度: 简单查看答案及解析
-
以下物质用途合理的是( )
A.食盐用于烹饪调味及腌制防腐
B.用烧碱改良农田酸性土壤
C.用熟石灰做食品包装袋内干燥剂
D.用氧气做瓜果蔬菜的保护气
难度: 简单查看答案及解析
-
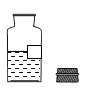
如图检查装置的气密性时,将导管末端伸入装水的烧杯中,用手捂住试管外壁,若装 置的气密性良好,烧杯内导管处(画圈部分)的现象是( )
选项
A
B
C
D

现象放大图
特征
导管中无水
导管口冒气泡
导管内上升 一段水柱
导管内外 水面相平
检查气密性
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
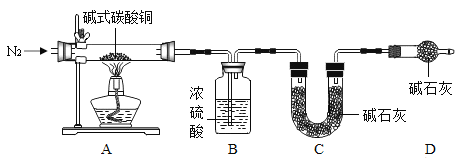
如图进行一氧化碳还原氧化铁的实验,以下分析错误的是()
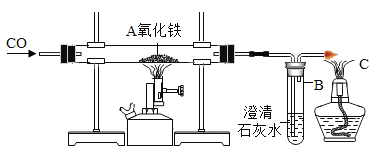
已知:①铁粉、四氧化三铁、氧化亚铁均为黑色;且四氧化三铁具有磁性;
②氧化铁还原过程受温度影响是逐步进行的:
A.实验时需要先通入一氧化碳一段时间,才能点燃酒精喷灯
B.B 处石灰水变浑浊可以说明 A 处反应已经发生
C.C 处点燃酒精灯的作用是处理尾气防止空气污染
D.当 A 处固体变黑且被磁铁吸引,说明发生了
的反应
难度: 中等查看答案及解析