-
某矿样含有大量的 CuS 及少量其它不溶于水、不与酸反应的杂质。实验室中 以该矿样为原料制备CuSO4·5H2O晶体,并最终制取碱式碳酸铜。
I. 制备CuSO4·5H2O晶体

(1)矿样中 CuS 在空气中焙烧生成了 CuO,反应方程式为___;
(2)在实验室中,欲用 98%、密度1.84g/cm3的浓硫酸配制500 g质量分数10%的稀硫酸, 需要的仪器除量筒、烧杯、玻璃棒外,还有___。稀释过程___(填“放热”或“吸 热”)。
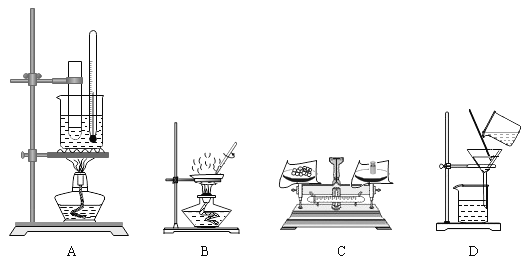
(3)若在实验室中完成系列操作 a,主要步骤为____→降温结晶→____→洗涤→低温干燥。(以上选填字母)
II. 制备碱式碳酸铜
(4)实验室制备碱式碳酸铜的反应原理为:(将短线上的物质补充完整)
 ____↑+2Na2SO4。
____↑+2Na2SO4。
(5)分别取 50mL一定浓度的CuSO4溶液与Na2CO3 溶液混合,发现反应后烧杯底部出现大量蓝绿色沉淀。查阅资料得知蓝绿色沉淀中混有难溶于水的碱式硫酸铜[Cu2(OH)2SO4]。为确定该物质,经过滤、洗净后取少量固体于试管中,加入足量稀盐酸将固体完全溶解,再滴加几滴____溶液出现白色沉淀,证明含有Cu2(OH)2SO4。
(6)按最佳配比进行实验制备碱式碳酸铜,反应过程中测得数据如下:
| 温度/℃ | 60 | 65 | 75 | 80 | 90 |
| 沉淀量/g | 1.295 | 1.303 | 1.451 | 1.340 | 1.292 |
据此分析制备反应控制的适宜温度是____,推测 90°C固体较少的原因是____。
(7)查阅资料可知碱式碳酸铜的组成有多种,可用xCu(OH)2•yCuCO3表示。某小组利用 以下装置测定某碱式碳酸铜样品的组成:(资料:碱式碳酸铜受热分解成三种常见的氧化物;碱石灰是氧化钙与氢氧化钠的混合物)
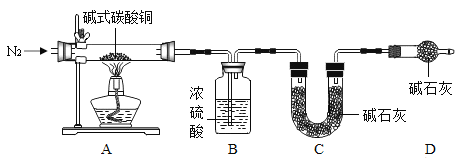
①加热时持续通入N2的目的是____,D 装置的作用是____。
②称取 32.0g 样品,充分反应后得到 24.0g 残留物,B 增重 3.6g,C 增重 4.4g。该样品的化学式为____。若对调 B 和 C 装置的位置,____(填“能”或“不能”)测算出该样品的化学式。
-
孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。现以孔雀石为原料制取胆矾(CuSO4·5H2O)的部分工艺流程如图。
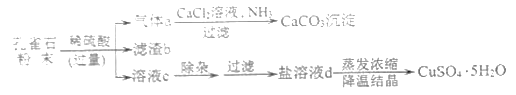
请回答:
(1)滤渣b的化学式为______。
(2)溶液c中的溶质有(写化学式):H2SO4、______、_______。
(3)盐溶液d的颜色为_______;实验室蒸发溶液时用到的玻璃仪器有_____(写1种)。
(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,X的名称为_______;孔雀石与稀硫酸反应生成气体a的化学方程式为________。
-
孔雀石主要成分为Cu2(OH)2CO3(难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。 现以孔雀石为原料制取胆矾(CuSO4﹒5H2O)的部分工艺流程如图所示。
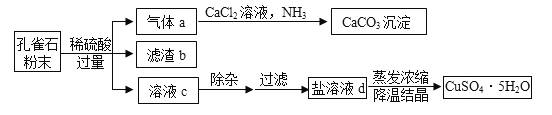
请回答: (1)滤渣b的化学式为___________。
(2)溶液c中的溶质含有的金属阳离子_______。
(3)写出盐溶液d中溶质的化学式__________;实验室蒸发溶液时用到的玻璃仪器有_______(写1种)。
(4)在气体a生成CaCO3的过程中,发生反应:  ,X的名称为___________。
,X的名称为___________。
-
以孔雀石为原料制取胆矾(CuSO4・5H2O)的部分工艺流程如图所示。

(查阅资料)
I.孔雀石主要成分为Cu2(OH)2CO3,还有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。
Ⅱ.胆矶是一种蓝色晶体,受热易分解。
Ⅲ.在该实验条件下,Fe(OH)3、Cu(OHI)2沉淀的pH如下表:
| Fe(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 1.14 | 4.2 |
| 完全沉淀的pH | 3.0 | 6.7 |
(1)操作1的名称为_____,实验室进行该操作时玻璃棒的作用是_____。
(2)气体a生成CaCO3的同时还生成NH4C1,该反应的化学方程式为_____。
(3)溶液c中的溶质有:CuSO4、H2SO4和_____(写化学式)
(4)为将溶液中的Fe3+全部转化为Fe(OH)3,沉淀而Cu2+不转化为Cu(OH)2沉淀,应调节pH=m,m的范围是_____。
(5)获得胆矾晶体时采用降温结晶而不用蒸发结晶的主要原因是_____。
-
孔雀石主要含Cu 2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4•5H2O及CaCO3的实验流程如图:

(吸收过程中发生反应的化学方程式为:CaCl2+2NH3+CO2+H2O→CaCO3↓+2NH4Cl)
请回答下列问题:
①溶解时,加稀H2SO4发生的主要反应的化学方程式为______.吸收过程中产生的可用作化肥的副产品名称是______.
②由滤液A获得CuSO4•5H2O,需要经过______、冷却结晶、过滤等操作.除烧杯、漏斗外,过滤操作还用到另一种玻璃仪器,该仪器在此操作中的主要作用是______.
③滤液中加少量CuO的目的是______.
-
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾(CuSO4·5H2O)。其设计的实验过程如下图所示:
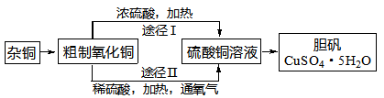
请回答下列问题:
 (1)杂质铜中有含有大量的碳粉,可采用在蒸发皿中灼烧的方法除去,其化学方程式为__________。
(1)杂质铜中有含有大量的碳粉,可采用在蒸发皿中灼烧的方法除去,其化学方程式为__________。
(2)灼烧后的蒸发皿中依然有黑色粉末,于是小华得出了碳粉没有反应完的结论,但遭到了其他同学的反对,他们的理由是__________。
A.灼烧过程中部分氧化铜被还原
B.灼烧不充分铜未被完全氧化
C.氧化铜在加热过程中分解生成铜
(4)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、__________(填操作名称)、冷却结晶。
(5)由粗制氧化铜通过途径Ⅰ制取胆矾的反应方程式为:Cu+2H2SO4(浓) CuSO4+2X+SO2↑,X的化学式为__________。与途径Ⅰ相比,途径Ⅱ的优点是__________(答出一点即可)。
CuSO4+2X+SO2↑,X的化学式为__________。与途径Ⅰ相比,途径Ⅱ的优点是__________(答出一点即可)。
-
一种工业废水中含有大量的硫酸亚铁、少量硫酸铜和污泥(污泥不溶于水,且不参与化学反应)。某同学设计了一个既经济又合理的实验方案,制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜。方案流程如下:
【查阅资料】FeSO4·7H2O受热易分解。
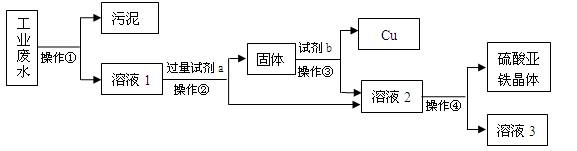
回答下列问题:
(1)加入过量试剂a的目的是 。
(2)操作③中产生气体的化学方程式是 。
(3)下列说法正确的是 。
A.溶液1中的溶质质量一定大于溶液2中的溶质质量
B.溶液3中的质量分数大于或等于溶液2
C.操作④中可以用蒸发溶剂结晶的方法
D.操作③中所加物质一定要适量
-
胆矾(CuSO4·5H2O)是一种重要的含铜化合物。胆矾溶于水得硫酸铜溶液。可用孔雀石为原料制取胆矾,部分工艺流程如如图。孔雀石主要成分为Cu2(OH)2CO3,还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质,Cu2(OH)2CO3难溶于水,与稀硫酸反应无沉淀生成。请回答:
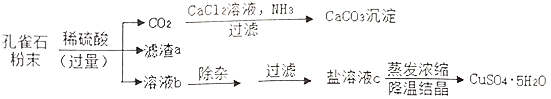
(1)在CO2生成CaCO3的过程中,发生反应:CO2+CaC12+2NH3+H2O=CaCO3↓+2X,X的名称为__
(2)滤渣a的化学式为_______________
(3)写出Fe2O3与稀硫酸反应的化学方程式:_______________________________________
(4)溶液b中的溶质有(写化学式):H2SO4、____________、__________________
(5)盐溶液c的颜色为__________,实验室蒸发溶液时用到的玻璃仪器有_____________(写出两种)。
(6)农业上可用硫酸铜溶液和熟石灰配置波尔多液,写出反应的化学方程式:___________________; 该反应的基本反应类型为_________________
(7)工业上可用电解硫酸铜的方法得到铜,其方程式为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4,电解产生64kg铜,能生成氧气________kg
-
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4 • 5H2O及纳米材料CaCO3,步骤如下:
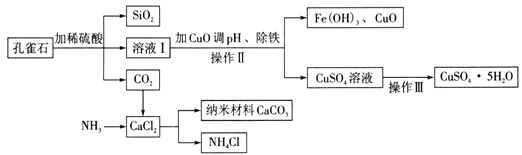
请回答下列问题:
(1)写出Cu2(OH)2CO3与稀硫酸反应的化学方程式:________ 。
(2)操作Ⅱ的名称为 __________ 。
(3)由CuSO4溶液获得CuSO4•5H2O,需要经过蒸发浓缩、_______ 、过滤、洗涤、干燥等操作。在实验室进行“蒸发浓缩”时,除铁架台、蒸发皿、酒精灯外,还用到另一玻璃仪器,该仪器是_________。
(4)制备纳米材料CaCO3时,应向CaCl2溶液中先通入NH3,后通入CO2。请写出该反应的化学方程式:_______________。
-
已知碱式碳酸铜[Cu2(OH)2CO3]受热易分解、能与酸反应.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.某学校化学研究小组以孔雀石为原料制备CuSO4•5H2O的流程如下:

请回答下列问题:
(1)流程中,X的化学式是______;由溶液B获得CuSO4•5H2O,需要经过加热蒸发、______、过滤等操作.
(2)若通过置换反应由溶液B制备金属铜,反应的化学方程式是______.
若选用下列物质与氧化铜反应制备铜,写出反应的化学方程式:
①选用非金属单质______ 2Cu+CO2↑或CuO+H2 Cu+H2O
Cu+H2O


____↑+2Na2SO4。









