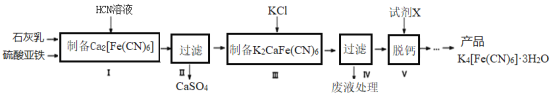
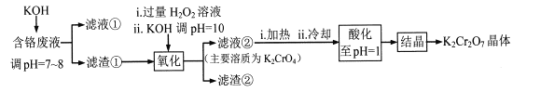
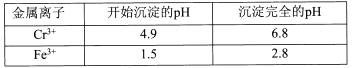
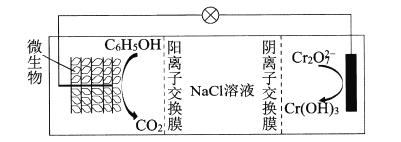
-
我国宋代沈括在《梦溪笔谈》中记载:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。熬胆矾铁釜,久之亦化为铜。”下列对文中加点词语的理解,正确的是
A. “苦泉”中泉水属于胶体 B. “熬”表示加热蒸馏
C. “胆矾”化学式为CuSO4 D. “化”表示置换转化
难度: 中等查看答案及解析
-
在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O ═ 2Fe2+ + 4SO42− + 4H+。实现该反应的物质间转化如图所示。下列分析正确的是
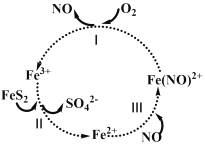
A.在酸性条件下,黄铁矿催化氧化中NO作催化剂
B.反应Ⅱ中Fe3+作氧化剂,FeS2被还原
C.反应Ⅰ的离子方程式为4Fe(NO)2+ + O2+ 4H+ ═ 4Fe3+ +4NO + 2H2O,Fe(NO)2+作氧化剂
D.反应Ⅲ的离子方程式为Fe2+ + NO ═Fe(NO)2+,该反应是氧化还原反应
难度: 中等查看答案及解析
-
硅及其化合物是带来人类文明的重要物质
下列说法正确的是
A.某硅酸盐的化学式为
,可用
表示
B.水玻璃是纯净物,可用于生产黏合剂和防火剂
C.陶瓷、水晶、水泥、玻璃都属于硅酸盐
D.高纯硅可用于制造光导纤维,高纯二氧化硅可用于制造太阳能电池
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1mol·L-1FeCl2溶液:Ba2+、K+、ClO-、H+
B.c(OH-)水=1×10-11mol/L:Na+、AlO2-、OH-、SO42-
C.0.1mol·L-1H2SO4溶液:Mg2+、K+、NH4+、NO3-
D.加入铝粉有氢气产生:NH4+、Na+、Cl-、CO32-
难度: 中等查看答案及解析
-
化学与生活、环境、科技等密切相关。下列说法不正确的是( )
A.温室效应导致海水的酸度增加,贝壳类生物的生存将会受到威胁
B.具有吸水性的植物纤维加工后可用作食品干燥剂
C.石墨烯弹性气凝胶制成的轻质“碳海绵”可用作处理海上原油泄漏的吸油材料
D.油脂的主要成分是高级脂肪酸甘油酯,长时间放置的油脂会因水解而变质
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.SO2具有氧化性,可用于漂白纸浆
B.Si的熔点高,可用作半导体材料
C.FeCl3溶液显酸性,可用于蚀刻铜制的电路板
D.漂白液中含有强氧化性物质,可作漂白剂和消毒剂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.2.3gNa与O2完全反应,转移电子总数为0.1NA
B.常温下,0.2mol/LNH4Cl溶液中,NH4+数目小于0.2NA
C.标准状况下,11.2LCHCl3中氯原子数目为1.5NA
D.7.8g苯中碳碳双键的数目为0.3NA
难度: 简单查看答案及解析
-
以下离子方程式书写正确的是
A.侯氏制碱法中NaHCO3的制备:Na+ + NH3 + CO2 + H2O ═ NaHCO3 ↓ + NH4+
B.向NH4HCO3溶液中加入足量石灰水:Ca2+ + HCO3-+OH-═ CaCO3↓ + H2O
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-═ Al2(CO3)3 ↓
D.用醋酸除去水垢:2H+ + CaCO3 ═ Ca2++CO2↑+H2O
难度: 简单查看答案及解析
-
2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示,下列说法正确的是( )
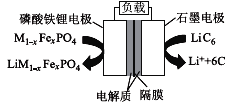
A.放电时,电流由石墨电极流向磷酸铁锂电极
B.电池总反应为M1-xFexPO4+LiC6
Li M1-xFexPO4+6C
C.放电时,负极反应式为LiC6-e-=Li++6C
D.充电时,Li+移向磷酸铁锂电极
难度: 中等查看答案及解析
-
钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:
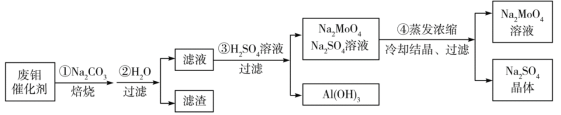
已知:MoO3,Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。
下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣并加入KSCN,溶液变为血红色
C.步骤③中可以用CO2代替硫酸
D.步骤④中可知Na2MoO4溶解度随温度变化较小
难度: 困难查看答案及解析
-
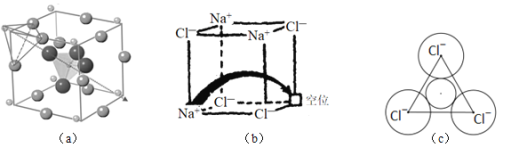
短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是
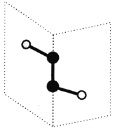
A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在
难度: 困难查看答案及解析
-
依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。其中装置正确且能达到相应实验目的是
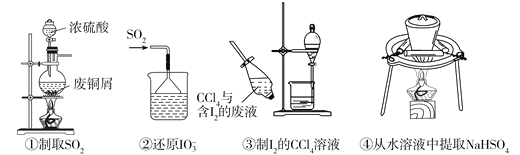
A.①②③④ B.①②③ C.②③④ D.②④
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.将FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1mol·L-1氨水中加入少量水,pH减小,KW减小
难度: 中等查看答案及解析
-
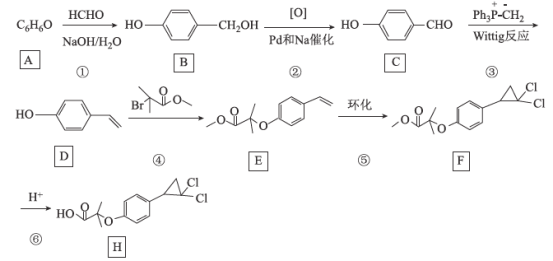
某药物丙可由有机物甲和乙在一定条件下反应制得:
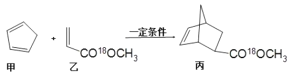
下列说法正确的是
A.丙在碱性条件下水解生成
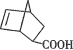 和CH318OH
和CH318OHB.甲分子中所有原子共平面
C.乙的化学式是C4H518OO
D.甲与乙生成丙的反应属于加成反应
难度: 中等查看答案及解析
-
常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数
(X)=
与pH的关系如图所示:
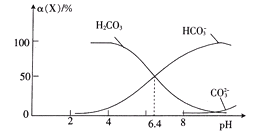
下列说法正确的是
A. 反应HCO3-
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
难度: 困难查看答案及解析
-
下列化学用语表达正确的是( )
A.中子数为8的氧原子:
O
B.次氯酸的结构式:H—O—Cl
C.氢化钠的电子式:NaH
D.CO2的比例模型:
难度: 中等查看答案及解析
-
根据下列实验操作和现象能得出相应结论的是
选项
实验操作和现象
结论
A
向一定浓度CuSO4溶液中通入H2S气体,出现黑色沉淀
H2S酸性比H2SO4强
B
向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物X溶液,加热未出现砖红色沉淀
X不可能是葡萄糖
C
常温下,相同铝片分别投入足量稀、浓硫酸中
反应物浓度越大,反应速率越大
D
取5mL0.1mol·L-1KI溶液,加入1mL0.1mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色
Fe3+与I-所发生的反应为可逆反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用CuCl2·2H2O晶体制取无水CuCl2的实验装置如图所示,下列说法错误的是
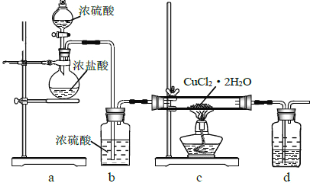
A. 通入HCl 可以抑制CuCl2 的水解 B. 先滴入浓硫酸,再点燃c 处酒精灯
C. 硬质玻璃管内部右侧会出现白雾 D. 装置d 中上层为苯,下层为NaOH 溶液
难度: 中等查看答案及解析
-
常温下,将除去表面氧化膜的A1、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。下列说法错误的是
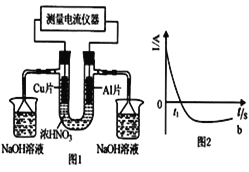
A. t1时刻前,A1片的电极反2A1-6e-+3H2O===A12O3+6H+
B. t1时,因A1在浓硝酸中钝化,氧化膜阻碍了A1继续反应
C. t1之后,负极Cu失电子,电流方向发生改变
D. 烧杯中发生的离子反应为:2NO2+2OH-=2NO3-+H2O
难度: 困难查看答案及解析
-
下列关于有机化合物的叙述中错误的是
A.汽油、柴油、石蜡都是多种碳氢化合物的混合物
B.利用酸性高锰酸钾溶液可除去CO2中混有的乙烯
C.苯与铁粉、溴水混合可制备密度大于水的溴苯
D.只用溴水可鉴别苯、己烯和四氯化碳
难度: 中等查看答案及解析
-
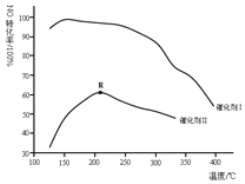
利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g)
N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4和1.2molNO2,测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:

下列说法正确的是
A.组别①中0 ~20 min内,NO2降解速率为0.0125mol•L-1•min-1
B.由实验数据可知温度T1<T2
C.40min时,表格中M对应的数据为0.18
D.该反应只有在高温下才能自发进行
难度: 困难查看答案及解析
-
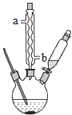
氯化铁是有机合成中常用的催化剂,如图是实验室模拟化工厂利用工业废铁屑(杂质不与盐酸反应)制备催化剂氯化铁的部分装置图,下列相关说法正确的是( )
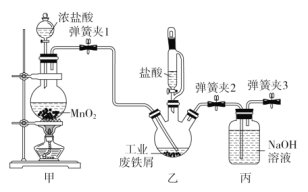
A.实验室也可以用装置甲制备SO2、C2H4
B.实验过程中,应先让装置乙中的反应进行一段时间后,再开始装置甲中的反应
C.实验过程中应该关闭弹簧夹3,让装置丙中的NaOH溶液充分吸收多余的Cl2
D.反应结束后将三颈烧瓶中的溶液加热浓缩、冷却结晶,可制得氯化铁晶体
难度: 中等查看答案及解析
-
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示。下列说法正确的是( )
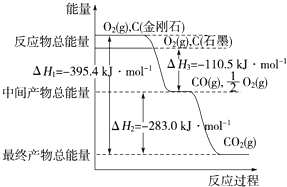
A.等质量的金刚石和石墨完全燃烧,石墨放出的热量更多
B.在通常状况下,金刚石和石墨相比,金刚石更稳定
C.表示石墨燃烧热的热化学方程式为C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
D.36 g石墨转化成金刚石,放出的热量为5.7 kJ
难度: 中等查看答案及解析
-
为了探究铁铜及其化合物的性质,某同学设计并进行了下列实验。下列说法错误的是
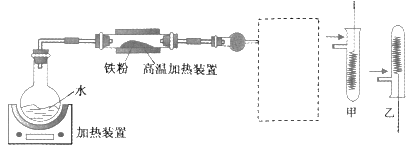
A. 高温加热装置中发生的反应为3Fe(s)+4H2O(g)
Fe3O4(s)+4H2(g)
B. 虚线框处宜选择的装置是甲
C. 实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑色变为红色
D. 实验后,可用铝粉在高温下还原玻璃管中的固体获得铁单质
难度: 中等查看答案及解析