-
下列不属于新能源的是
A. 潮汐能 B. 太阳能 C. 风能 D. 石油
难度: 简单查看答案及解析
-
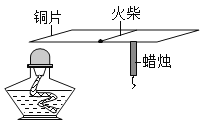
下列变化中,属于化学变化的是( )
A.干冰升华 B.食物腐败 C.铁丝弯曲 D.汽车爆胎
难度: 简单查看答案及解析
-
“富硒猕猴桃”中的“硒”是指( )
A.硒原子
B.硒元素
C.硒单质
D.硒分子
难度: 简单查看答案及解析
-
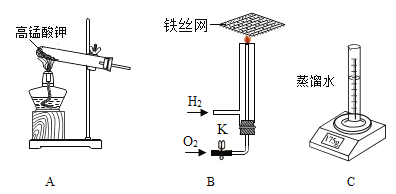
下列物质在氧气中燃烧产生大量白烟的是
A.红磷 B.木炭 C.铁丝 D.甲烷
难度: 中等查看答案及解析
-
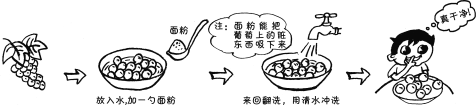
下列物质放入水中,能形成溶液的是
A.食盐 B.牛奶 C.面粉 D.植物油
难度: 简单查看答案及解析
-
下列物质中,属于氧化物的是( )
A.O2 B.H2O C.KCl D.AgNO3
难度: 简单查看答案及解析
-
下列有关物质用途的叙述中,不正确的是( )
A.铜丝用作导线 B.碳酸钙用作补钙剂
C.浓硫酸用作食品干燥剂 D.小苏打用于焙制糕点
难度: 简单查看答案及解析
-
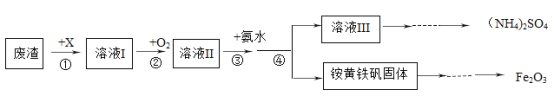
粗盐中难溶性杂质去除的实验步骤如下图所示。有关该实验的说法中,不正确的是( )
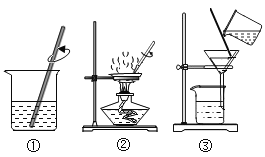
A.实验步骤是①③② B.步骤②出现大量固体时停止加热
C.步骤③漏斗中液面低于滤纸边缘 D.各步操作均需用玻璃棒搅拌
难度: 简单查看答案及解析
-
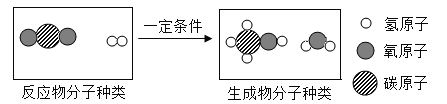
高铁轨道焊接时发生的反应为8Al+3Fe3O4
4Al2O3+9Fe,该反应属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 简单查看答案及解析
-
丙烯是液化石油气的主要成分之一、下列有关叙述正确的是( )
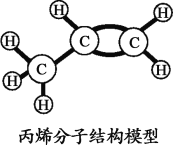
A.丙烯由碳、氢原子构成
B.丙烯中碳元素的质量分数最大
C.丙烯中碳、氢元素质量比为1:2
D.丙烯分子由碳、氢元素组成
难度: 简单查看答案及解析
-
下列实验操作不能达到实验目的的是( )
实验目的
实验操作
A
除去氧气中的二氧化碳
通过足量的氢氧化钠溶液
B
检验某固体为碳酸盐
取样,滴加稀盐酸,观察是否有气泡产生
C
鉴别空气和氧气
分别伸入燃着的木条,观察现象
D
鉴别水和双氧水
取样,分别加入二氧化锰,观察是否有气泡产生
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
分析如图溶解度曲线,下列说法不正确的是( )
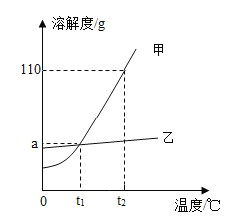
A.t1℃时,甲和乙的溶解度相等
B.t2℃时,甲的溶解度为110g
C.将t1℃时两种物质的饱和溶液升温至t2℃,溶质质量分数:甲>乙
D.t2℃时,等质量的两种物质的饱和溶液中,所含溶质质量:甲>乙
难度: 简单查看答案及解析