-
向100mL3mol/L的硫酸溶液中加入过量的锌粉发生反应,为了加快化学反应速率但又不影响生成氢气的总量,可向反应物中加入适量的 ①K2SO4溶液 ②Na2CO3固体 ③水 ④NaNO3固体 ⑤CuSO4粉末 ⑥6mol/L的硫酸
A. ①② ③ B. ④⑤⑥ C. ③④⑤ D. 只有⑤
难度: 中等查看答案及解析
-
下列实验误差分析不正确的是
A. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,读取数值偏小
D. 用沾有水珠的锥形瓶盛装待测液进行滴定,测定浓度偏小
难度: 简单查看答案及解析
-
下列反应中,生成物的总能量大于反应物总能量的是( )
A.乙烷在氧气中燃烧 B.氢氧化钠溶液与硫酸溶液混合
C.氧化钙与水反应 D.水蒸气与碳高温下反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.反应N2(g)+3H2(g)⇌2NH3(g)的△H<0,△S>0
B.在稀溶液中,H+(aq)+OH-(aq)═H2O(l) 中和热△H=-57.3 kJ•mol-1
C.燃烧热就是物质燃烧时所放出的热量
D.升高温度或加入催化剂,可以改变化学反应的反应热
难度: 简单查看答案及解析
-
N2(g)+3H2(g)
2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确

A.该反应正反应的活化能小于逆反应的活化能
B.该反应的逆反应为放热反应
C.使用催化剂使该反应的反应热发生改变
D.该反应的ΔH=E2-E1
难度: 中等查看答案及解析
-
根据热化学方程式S(s)+O2(g)==SO2(g)ΔH=—297.2kJ/mol分析,下列说法中不正确的是
A.S(s)在O2(g)中燃烧是放热反应
B.16g固体硫在空气中充分燃烧,可放出148.6kJ的热量
C.反应S(g)+O2(g)==SO2(g)的ΔH大于—297.2kJ/mol
D.1molSO2(g)所具有的能量小于1molS(s)与1molO2(g)所具有的能量之和
难度: 中等查看答案及解析
-
下列有关能量转化的说法不正确的是( )
A.化石能源只要充分燃烧就不会对环境产生危害
B.植物的光合作用是吸热过程
C.由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
D.燃料燃烧时不只是将化学能转化为热能
难度: 中等查看答案及解析
-
今有反应X(g)+Y(g)
2Z(g)(正反应放热),右图表示该反应在t1时达到平衡,在t2 时因改变某个条件而发生变化的曲线。则下图中的t2时改变的条件是( )
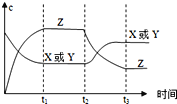
A.升高了反应体系的温度 B.增大了x或y的浓度
C.增大了反应体系的压强 D.使用了催化剂
难度: 中等查看答案及解析
-
某温度下反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)开始进行时,c(NH3)=0.04mol/L,经5min后,c(NH3)=0.03mol/L,则v(H2O)为( )
A.0.003mol/(L•min) B.0.002mol/(L•min)
C.0.0045mol/(L•min) D.0.003mol/(L•s)
难度: 简单查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是( )
A.向AgCl浊液中加入少量KI溶液,可看到白色沉淀变为黄色沉淀
B.高压比常压更有利于N2和H2转化为NH3
C.蒸干AlCl3溶液无法得到无水AlCl3
D.滴加少量CuSO4溶液可以加快Zn与稀H2SO4反应的速率
难度: 中等查看答案及解析
-
图是可逆反应A+2B
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断

A. A、B、C、D均为气体
B. 若A、 B是气体,则C、 D是液体或固体
C. 温度越高,K越大
D. 在整个过程中,A的转化率一直增大
难度: 中等查看答案及解析
-
常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
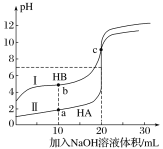
A.滴定过程中,水电离的c(H+)·c(OH-)均不变
B.相同条件下,HB的电离程度小于HA的电离程度
C.V=10mL时,c(HB)+c(B-)=2c(Na+)
D.V=20mL时,c(A-)>c(B-)
难度: 困难查看答案及解析
-
室温下,向10mL 0.1mol•L-1的CH3COOH溶液加蒸馏水稀释到1L后,下列变化正确的是( )
①电离程度增大 ②
减小 ③c(H+)增大 ④导电性增强 ⑤
增大
A.仅①②③ B.仅①③④ C.仅①②⑤ D.仅②③④
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是
A.Na2S溶液中:2c(Na+)=c(S2‒)+c(HS‒)+c(H2S)
B.Na2CO3溶液中:c(OH‒)=c(H+)+c(HCO3‒)+2c(H2CO3)
C.0.1mol•L﹣1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3‒)+c(CO32‒)+c(OH‒)
D.pH相同的①CH3COONa、②NaOH、③NaClO三种溶液的c(Na+):③>①>②
难度: 中等查看答案及解析
-
25℃时,向1L 0.1mol/L的一元酸HR溶液中逐渐通入氨气(已知25℃时一水合氨的电离平衡常数为K=1.76×10-5),保持溶液的温度和体积不变,混合溶液的pH与粒子浓度比值的对数变化关系如图所示。下列叙述错误的是
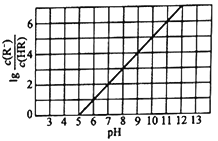
A. 25℃时,0.1mol/L的一元酸HR的电离平衡常数为Ka=10-5
B. 当通入0.1mol氨气时,c(NH4+)>c(R-)>c(OH-)>c(H+)
C. 当c(R-)=c(HR) 时,溶液为酸性
D. HR为弱酸,25℃时随着氨气的通入,c (R-)/[c(OH−)•c (HR)] 逐渐增大
难度: 困难查看答案及解析
-
下图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,下列说法正确的是( )
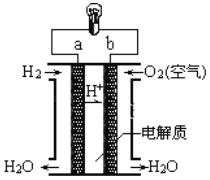
A.氢氧燃料电池的总反应化学方程式是2H2+O2=2H2O B.a极是正极
C.
向正极移动 D.阴极的电极反应式:O2+4H++4e-=2H2O
难度: 中等查看答案及解析
-
对下列有关现象或事实解释正确的是( )
选项
现象或事实
解释
A
乙醇、过氧化钠、次氯酸钠等均可用于消毒
都具有氧化性,可将病毒氧化而达到消毒的目的
B
患者服用“钡餐”做胃部造影
钡盐无毒且不溶于水、酸
C
钢铁在潮湿的空气中放置容易生锈
在潮湿的空气中,铁与水、氧气易发生化学腐蚀生成铁锈
D
在燃煤中添加生石灰用于减少二氧化硫的排放
高温下,二氧化硫可与生石灰发生反应,生成亚硫酸钙固体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5 表示。有关说法正确的是

A. 该装置为原电池,b为原电池的负极
B. 中间室Na+移向右室,Cl-移向左室,a极区溶液的pH减小
C. 当左室有4.48L(标准状况下)CO2生成时,右室产生的N2为0.8mol
D. b电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
难度: 困难查看答案及解析
-
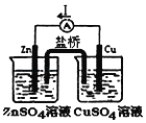
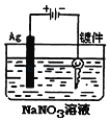
如图实验装置,其中按要求设计正确的是( )
A.铜锌原电池
 B.电解饱和食盐水
B.电解饱和食盐水
C.电镀银
 D.电解精炼铜
D.电解精炼铜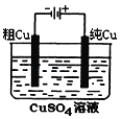
难度: 简单查看答案及解析
-
如图所示的装置中, a、b为石墨电极,通电一段时间后,b极附近显红色。下列说法不正确的是
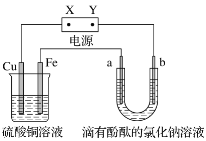
A. b电极反应式为2H++2e-=H2↑ B. a电极反应式为2Cl--2e-=Cl2↑
C. 铁电极反应式为Cu2++2e-=Cu D. 铜电极反应式为4OH--4e-=O2↑+2H2O
难度: 中等查看答案及解析