-
下列关系与共价键键能无关的是( )
A.热稳定性:HCl>HBr B.熔沸点:SiO2>SiC
C.熔沸点:C12>F2 D.熔沸点:金刚石>单晶硅
难度: 简单查看答案及解析
-
日本大地震引发的福岛第一核电站核泄漏事故,造成放射性物质
和
向外界泄漏。下列相关说法正确的是
A.每个
原子中有82个质子 B.CsOH的碱性比NaOH弱
C.KIO3是碘的最高价氧化物的水化物的盐 D.I¯比F¯还原性强
难度: 简单查看答案及解析
-
下列试剂用自来水配制不会导致药品变质的是
A.硝酸银 B.氯化钠 C.亚硫酸钠 D.硫代硫酸钠
难度: 简单查看答案及解析
-
可以判断油脂皂化反应基本完成的现象是
A.反应液使红色石蕊试纸变蓝 B.反应后静置,反应液不分层
C.反应后静置,反应液分为两层 D.反应液使蓝色石蕊试纸变红
难度: 简单查看答案及解析
-
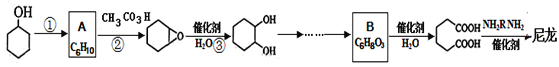
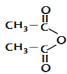
下列化学用语或模型表示正确的是
A.硝基苯的结构简式:
B.COCl2分子的电子式:
C.过氧化氢的电子式:
D.NaCl的晶体模型:
难度: 中等查看答案及解析
-
离子互换反应的实质是“永远向着某些离子浓度减少的方向进行”,下列反应不符合这一实质的是
A.AgCl + 2NH3·H2O →[Ag(NH3)2]Cl + 2H2O
B.CuSO4 + H2S → CuS↓+ H2SO4
C.KCl(l) + Na(l) → K↑+NaCl(l)
D.2[Ag(NH3)2]Cl + Na2S → Ag2S↓+ 2NaCl + 4NH3
难度: 困难查看答案及解析
-
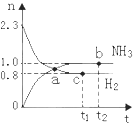
化学家发明了一种合成氨的新方法。在常压下,用多孔钯多晶薄膜的催化将氢气和氮气转化为氨气。以下有关叙述正确的是
A.增加氮气的量能提高氢气的转化率
B.升高温度有利于氨气的合成
C.采用冷水降温的方法将合成混合气体中的氨气液化
D.此法与哈伯法合成氨工艺相近
难度: 中等查看答案及解析
-
研究者预想合成一个纯粹由氮组成的新物种—N5+N3-,若N5+离子中每个氮原子均满足8电子结构,以下有关N5+推测正确的是
A.N5+有24个电子 B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键 D.N5+在水中可以稳定存在
难度: 困难查看答案及解析
-
钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是:反应Ⅰ: aTiO2+bCl2+cC
aTiCl4+cCO 反应Ⅱ:TiCl4+2Mg
Ti+2MgCl2,关于反应Ⅰ、Ⅱ的下列说法中正确的是
A.反应Ⅰ中的TiO2是氧化剂
B.TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂
C.a=b=c=2
D.每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子
难度: 中等查看答案及解析
-
葡萄糖燃烧的热化学反应方程式:C6H12O6(s)+6O2(g) → 6CO2(g)+6H2O(l)+2870kJ,此反应说明
A.自然界中的一切物质的能量均来自太阳
B.人体每摄入1摩尔葡萄糖,就为人体提供2870kJ能量
C.人体所需的能量均来自于葡萄糖的氧化
D.1摩尔固态葡萄糖和6摩尔氧气所含能量大于6摩尔CO2和6摩尔液态水所含的总能量
难度: 简单查看答案及解析
-
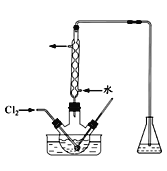
如下图装置(夹持装置略,气密性已检验)某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体,下列推断不合理的是
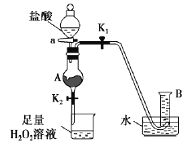
A.B中收集到的气体是氢气
B.烧杯中双氧水溶液作用是将Fe2+还原为Fe3+
C.A中的氧化铁与盐酸反应生成氯化铁
D.烧杯中溶液在氯化氢气氛下,蒸发浓缩、冷却结晶、过滤后得到氯化铁晶体
难度: 中等查看答案及解析
-
糕点包装中常见的脱氧剂组成:还原性铁粉、氯化钠、炭粉等。脱氧过程中
A.发生析氢腐蚀
B.铁粉作阴极发生氧化反应
C.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
D.可以吸热,从而降低温度,起保鲜糕点的作用
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
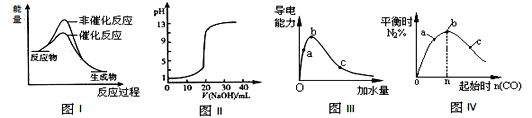
A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.1000mol/LNaOH溶液滴定20.00mL、0.0100mol/LHCl溶液所得到的滴定曲线
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c < a < b
D.图Ⅳ表示反应4CO(g)+2NO2(g)
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c > b > a
难度: 困难查看答案及解析
-
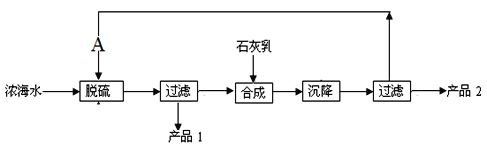
与氨碱法相比较,联合制碱法最突出的优点是
A. 设备少 B. 原料易得
C. 循环利用的物质多 D. NaCl利用率高
难度: 中等查看答案及解析
-
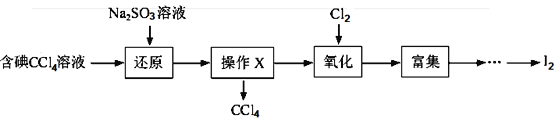
目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:

以下推断不合理的是( )
A. 热空气能吹出溴是利用溴易挥发的性质
B. SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C. 流程中循环利用的物质有SO2、Br2、Cl2等
D. 没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
难度: 简单查看答案及解析
-
铁铜合金中逐滴加入稀硝酸的过程中,下列离子方程式较难发生的是
A.Fe + 4H++ NO3-→ Fe3++ NO↑+ 2H2O
B.3Fe + 8H++ 2 NO3-→ 3Fe2++ 2NO↑+ 4H2O
C.3Cu + 8H++ 2 NO3-→ 3Cu2++ 2NO↑+ 4H2O
D.3Fe2++ 4H++ NO3-→ 3Fe3++ NO↑ + 2H2O
难度: 简单查看答案及解析
-
在含有Na+的溶液中,还可能存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的一种或几种,进行如下实验:
(1)原溶液滴加少量氯水后,有气泡生成,溶液呈橙黄色;
(2)向橙黄色溶液中加BaCl2溶液无沉淀生成;
(3)橙黄色溶液不能使淀粉变蓝。由此推断原溶液中一定不存在的离子是
A.NH4+、Br-、CO32- B.Fe2+、I-、SO32-
C.Fe2+、I-、CO32- D.NH4+、I-、SO32-
难度: 困难查看答案及解析
-
0.1 mol·L-1的稀盐酸与0.2 mol·L-1醋酸钠溶液等体积完全反应后,测得反应后的溶液中c(CH3COO-)>c(Cl-),则下列判断中错误的是
A.温度为298 K时,pH<7 B.c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1
C.c(CH3COOH) < c(CH3COO-) D.c(CH3COO-)+c(OH-)=c(Na+)+c(H+)
难度: 困难查看答案及解析
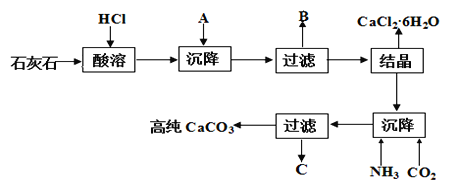
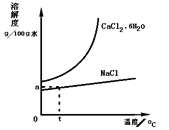
 CaCl2·6H2O
CaCl2·6H2O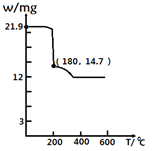
 )
)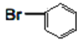 +CH3OOCCH=CH2(Ⅰ)
+CH3OOCCH=CH2(Ⅰ)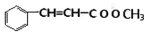 (Ⅱ)
(Ⅱ)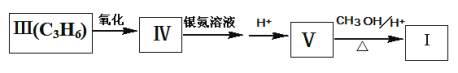
 B……
B……