-
科学的假设与猜想是科学探究的先导与价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是
A. 探究Na与水反应可能有O2生成
B. 探究Na2O2与SO2反应可能有Na2SO4生成
C. 探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能含有CuS
D. 探究向滴有酚酞的NaOH溶液中通入Cl2,溶液红色褪去的原因是溶液酸碱性改变所致,还是HClO的漂白性所致
难度: 中等查看答案及解析
-
化学反应中,物质的用量不同或浓度不同或反应条件不同会对生成物产生影响。下列反应的生成物不受反应物的用量或浓度或反应条件影响的是
A. 二氧化硫与氢氧化钠溶液反应 B. 钠与氧气的反应
C. 铁在硫蒸气中燃烧 D. 铁粉加入硝酸中
难度: 中等查看答案及解析
-
2015年12月31日,日本获得第113号元素的正式命名权.这种原子(记作
),是由30号元素Zn,连续轰击83号元素Bi获得的.下列说法,不正确的是
A.获得新核素
的过程,是一个化学变化
B.题中涉及的三种元素,都属于金属元素
C.这种超重核素
的中子数与质子数只差为52
D.这种新核素,是同主族元素中原子半径最大的
难度: 中等查看答案及解析
-
下列有关物质的用途叙述中,不正确的是
A.用稀硫酸除钢铁表面的铁锈利用了硫酸的酸性
B.干冰用于人工降雨,是利用了干冰升华吸热
C.胃药中含氢氧化镁是因为氢氧化镁能给人提供镁元素
D.碳酸氢钠作焙制糕点的发酵粉是利用了碳酸氢钠能与发醇面团中的酸性物质反应
难度: 中等查看答案及解析
-
下列有关物质结构的叙述正确的是
A.在离子化合物中不可能存在非极性共价键
B.由电子定向移动而导电的物质一定是金属晶体
C.有键能很大的共价键存在的物质熔沸点一定很高
D.只含有共价键的物质不一定是共价化合物
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.CO2通入饱和Na2CO3溶液中
B.SO2通入CaCl2溶液中
C.NH3通入HNO3和AgNO3的混和溶液中
D.SO2通入Na2S溶液中
难度: 中等查看答案及解析
-
下列过程中,共价键被破坏的是
A.木炭吸附溴蒸气 B.干冰升华
C.葡萄糖溶于水 D.氯化氢溶于水
难度: 简单查看答案及解析
-
下列物质能通过化合反应直接制得的是
①FeCl2②H2SO4③NH4NO3④HCl
A.只有①②③ B.只有②③ C.只有①③④ D.全部
难度: 中等查看答案及解析
-
有氯气参加的化学反应一定不属于
A.复分解反应 B.置换反应 C.取代反应 D.加成反应
难度: 中等查看答案及解析
-
某无色溶液中含Na+、I-、NO3-、Cl-,加入下列哪种溶液不会使其变色
A.淀粉溶液 B.硫酸氢钠溶液 C.H2O2溶液 D.氯水
难度: 中等查看答案及解析
-
不符合ⅦA族元素性质特征的是
A.从上到下原子半径逐渐减小 B.易形成-1价离子
C.最高价氧化物的水化物显酸性 D.从上到下氢化物的稳定性依次减弱
难度: 中等查看答案及解析
-
在下列有机物中,经催化加氢后不能生成2﹣甲基戊烷的是
A.CH2=C(CH3)CH2CH2CH3 B.CH2=CHCH(CH3)CH2CH3
C.CH3C(CH3)=CHCH2CH3 D.CH3CH=CHCH(CH3)CH3
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol过氧化钠中阴离子所带的负电荷数为NA
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA
C.28 g C16O与28 g C18O中含有的质子数均为14 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
难度: 中等查看答案及解析
-
下列关于电化学的实验事实正确的是( )
出现环境
实验事实
A
以稀H2SO4为电解质的Cu-Zn原电池
Cu为正极,正极上发生还原反应
B
电解CuCl2溶液
电子经过负极→阴极→电解液→阳极→正极
C
弱酸性环境下钢铁腐蚀
负极处产生H2,正极处吸收O2
D
将钢闸门与外加电源负极相连
牺牲阳极阴极保护法,可防止钢闸门腐蚀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)═C(石墨)△H=﹣1.9 kJ•mol﹣1 可知,金刚石比石墨稳定
C.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJ•mol﹣1
D.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ•mol﹣1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
难度: 中等查看答案及解析
-
在实验室进行下列有关的物质制备中,理论上正确、操作上可行、经济上合理的是
A.C
CO
CO2
Na2CO3
B.Cu
Cu(NO3)2溶液
Cu(OH)2
C.Fe
Fe2O3
Fe2(SO4)3溶液
D.CaO
Ca(OH)2溶液
NaOH溶液
难度: 中等查看答案及解析
-
有X、Y、Z、W、M五种原子序数增大的短周期元素,其中X、M同主族; Z+与Y2-具有相同的电子层结构,W是地壳中含量最多的金属,X与W的原子序数之和等于Y与Z的原子序数之和;下列序数不正确的是
A.离子半径大小:r(Y2-)>r(W3+)
B.W的氧化物对应的水化物可与Z的最高价氧化物水化物反应
C.X有多种同素异形体,而Y不存在同素异形体
D.X、M均能与氯形成由极性键构成的正四面体非极性分子
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
难度: 中等查看答案及解析
-
乙酸香兰酯是用于调配奶油、冰淇淋的食用香精,其合成反应的化学方程式如下:
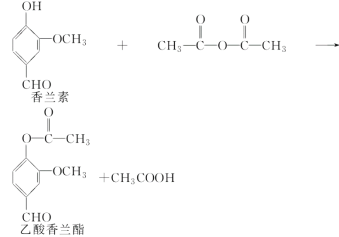
下列叙述正确的是( )
A.该反应不属于取代反应
B.乙酸香兰酯的分子式为C10H8O4
C.FeCl3溶液可用于区别香兰素与乙酸香兰酯
D.乙酸香兰酯在足量NaOH溶液中水解得到乙酸和香兰素
难度: 中等查看答案及解析
-
700℃时,H2(g)+CO2(g)
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度
甲
乙
丙
C(H2)/mol/L
0.1
0.2
0.2
C(CO2)/mol/L
0.1
0.1
0.2
A.平衡时,乙中CO2的转化率大于50%
B.当反应平衡时,丙中c(CO2)是甲中的2倍
C.温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D.其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
难度: 中等查看答案及解析
-
12mL NO和NH3的混合气体在一定条件下发生可逆反应:6NO+4NH3
5N2+6H2O,若还原产物比氧化产物多1mL(气体体积在相同状况下测定),则原混合气体中NO和NH3体积比可能是
A.2:1 B.1:1 C.3:2 D.4:3
难度: 中等查看答案及解析
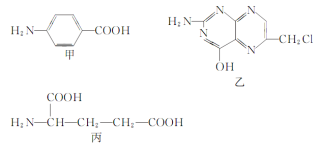
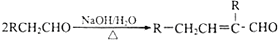 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜。E的一种合成路线如下: