-
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
(1)炼钢开始和结束阶段都可能发生反应:Si+2FeO 2Fe+SiO2,其目的是________________.
2Fe+SiO2,其目的是________________.
A.得到副产品硅酸盐水泥 B.制取SiO2,提升钢的硬度
C.除去生铁中过多的Si杂质 D.除过量FeO,防止钢变脆
(2)一种由粗硅制纯硅过程如下:Si(粗) SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯) Si(纯),在上述由SiCl4制纯硅的反应中,测得每生成 1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________.
Si(纯),在上述由SiCl4制纯硅的反应中,测得每生成 1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________.
对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是________________
A.NaX易水解
B.SiX4是共价化合物
C.NaX的熔点一般高于SiX4
D.SiF4晶体是由共价键形成的空间网状结构
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解也可以生成高纯硅.硅烷的热稳定性弱于甲烷,所以Si元素的非金属性弱于C元素,用原子结构解释其原因:________________.
(4)此外,还可以将粗硅转化成三氯氢硅(SiHCl3),通过反应:SiHCl3(g)+H2(g)⇌Si(s)+3HCl(g)制得高纯硅.不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示.下列说法正确的是________________(填字母序号).
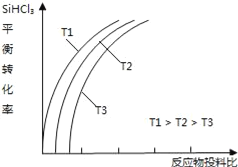
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是
c.实际生产中为提高SiHCl3的利用率,可适当降低压强
(5)硅元素最高价氧化物对应的水化物是H2SiO3.室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是___________,其原因是________________.已知:H2SiO3:Ka1=2.0×10﹣10、Ka2=1.0×10﹣12,H2CO3:Ka1=4.3×10﹣7 Ka2=5.6×10 ﹣11.
-
下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素, 在自然界中只以化合态的形式存在
②陶瓷、水泥、玻璃、水晶饰物都是硅酸盐制品
③硅的最高价氧化物不与任何酸反应
④二氧化硅是高熔点、硬度大的原子晶体,广泛用作光导纤维
⑤硅的气态氢化物比甲烷不稳定
A.①②⑤ B.②③④ C.①④⑤ D.③④⑤
-
硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:___________。
②常温下,不能与R单质发生反应的是_______(选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因__________________。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:______________________。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。_______________。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
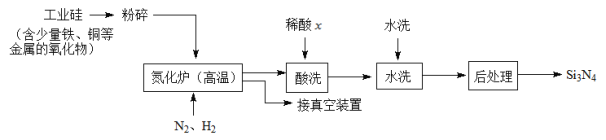
①将工业硅粉碎的目的是______________________________。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。 可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
可能是______(选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________。
-
硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
I.某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为________________;
(2)写出M原子核外能量最高的电子的电子排布式:__________________;
(3)常温下,不能与R单质发生反应的是___________(选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(4)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式:____________________________________________。
II.氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
(5)Si3N4晶体中只有极性共价键,则氮原子的化合价为______,被还原的元素为______________。
(6)C3N4的结构与Si3N4相似。请比较二者熔点高低。并说明理由:_____________________。
(7)配平上述反应的化学方程式,并标出电子转移的数目和方向。_________________
(8)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_____________。
-
发现新材料是现代科技发展的方向之一。下列有关材料的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②新型合金材料的硬度比成分金属大,熔点比成分金属高
③高纯度的硅单质广泛用于制作光导纤维
④生铁和钢都可以完全溶解于足量的盐酸中
⑤氮化硅陶瓷属于新型无机非金属材料
A.①② B.②③ C.①⑤ D.①③④
-
下列关于硅单质及其化合物的说法正确的是 ( )
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
-
下列关于硅单质及其化合物的说法正确的是 ( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③ C.①④ D.③④
-
下列关于硅单质及其化合物的说法正确的是
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维 ④陶瓷是人类应用很早的硅酸盐材料
A. ①② B. ②③ C. ①④ D. ③④
-
下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.②③
C.①④ D.③④
-
下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④陶瓷是人类应用很早的硅酸盐材料
A.①② B.①④ C.②③ D.③④
2Fe+SiO2,其目的是________________.
SiCl4
SiCl4(纯)
Si(纯),在上述由SiCl4制纯硅的反应中,测得每生成 1.12kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________.

