硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
I.某些硅酸盐具有筛选分子的功能,一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期。两元素原子的质子数之和为24。
(1)该硅酸盐中同周期元素原子半径由大到小的顺序为________________;
(2)写出M原子核外能量最高的电子的电子排布式:__________________;
(3)常温下,不能与R单质发生反应的是___________(选填序号);
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.Na2CO3溶液
(4)写出M、R两种元素的最高价氧化物对应的水化物反应的离子方程式:____________________________________________。
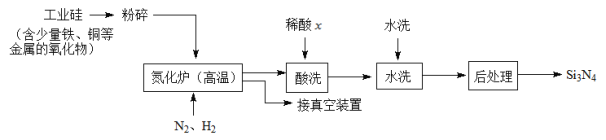
II.氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2Si3N4+CO
(5)Si3N4晶体中只有极性共价键,则氮原子的化合价为______,被还原的元素为______________。
(6)C3N4的结构与Si3N4相似。请比较二者熔点高低。并说明理由:_____________________。
(7)配平上述反应的化学方程式,并标出电子转移的数目和方向。_________________
(8)如果上述反应在10L的密闭容器中进行,一段时间后测得气体密度增加了2.8g/L,则制得的Si3N4质量为_____________。
高三化学综合题中等难度题